Cho bột nhôm tác dụng với dung dịch NaOH (dư) thu được 6,72 lít khí H 2 (ở đktc). Khối lượng bột nhôm đã phản ứng là
A. 10,4gam
B. 16,2gam
C. 2,7gam
D. 5,4gam
Cho bột nhôm tác dụng với dung dịch NaOH (dư) thu được 6,72 lít khí H2 (ở đktc). Khối lượng bột nhôm đã phản ứng là
A. 2,7gam
B. 5,4gam
C. 16,2gam
D. 10,4gam
Cho bột nhôm tác dụng với dung dịch NaOH (dư) thu được 6,72 lít khí H2 (ở đktc). Khối lượng bột nhôm đã phản ứng là
A. 5,4 gam.
B. 10,4 gam.
C. 16,2 gam.
D. 2,7 gam.
Đáp án A
nH2 = 6,72: 22,4 = 0,3 mol
NaOH + Al + H2O → NaAlO2 + 1,5H2
mol 0,2 ← 0,3
=> mAl = 0,2.27 = 5,4g
Cho bột nhôm tác dụng với dung dịch NaOH dư thu được 6,72 lít khí H2 đktc. Khối lượng bột nhôm đã phản ứng là
A. 2,7 gam
B. 16,2 gam
C. 5,4 gam
D. 10,4 gam
Giải thích:
2NaOH + 2Al + H2O→ NaAlO2 + 3H2
nH2= 0,3 mol → nAl = 0,2 mol →mAl =5,4 g
Đáp án C
cho m gam bột nhôm tác dụng hoàn toàn với dung dịch Axitsunfuric loãng 30%, thu được muối nhôm sunfat và 6,72 lít khí H2 ở đktc.
a) viết PTPƯ
b) tính khối lượng bột nhôm cần dùng
c) tính khối lượng dung dịch axitsunfuric cần dùng
a) 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
b) \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
0,2<----0,3<-----------------0,3
=> mAl = 0,2.27 = 5,4 (g)
c) \(m_{dd.H_2SO_4}=\dfrac{0,3.98}{30\%}=98\left(g\right)\)
Một hỗn hợp X gồm Al và Fe 2 O 3 . Thực hiện phản ứng nhiệt nhôm hoàn toàn X thu được chất rắn A. A tác dụng với dung dịch NaOH dư thu được 6,72 lít H 2 (đktc) và chất rắn B. Cho B tác dụng với H 2 SO 4 loãng dư sinh ra 6,72 lít khí (đktc). Khối lượng hỗn hợp X đã dùng là
A. 29,50 gam
B. 45,50 gam
C. 37,5 gam
D. 26,80 gam
Cho hỗn hợp gồm bột nhôm và oxit sắt. Thực hiện hoàn toàn phản ứng nhiệt nhôm (giả sử chỉ có phản ứng oxit sắt thành Fe) thu được hỗn hợp chất rắn B có khối lượng 19,82 g. Chia hỗn hợp thành 2 phần bằng nhau:
- Phần 1: cho tác dụng với một lượng dư dung dịch NaOH thu được 1,68 lít khí H2 (đktc).
- Phần 2: cho tác dụng với một lượng dư dung dịch HCl thì có 3,472 lít khí H2 (đktc) thoát ra.
Công thức của oxit sắt là
A. Fe2O3.
B. Fe3O4.
C. FeO.
D. Không xác định được.
Đáp án A
Ta có sơ đồ phản ứng:
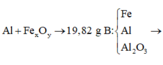
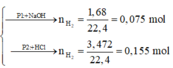
Phần 1:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
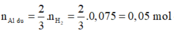
![]()
Phần 2:
2Al + 6HCl → 2AlCl3 + 3H2↑ (1)
0,05 → 0,075
Fe + 2HCl → FeCl2 + H2↑ (2)
![]()
![]()
![]()
![]()
Ta có phương trình phản ứng:
![]()
Khối lượng các chất trong 1 phần hỗn hợp B là 19,82/2 = 9,91 g
![]()
![]()
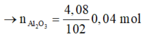
Ta có:
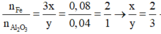
=> Oxit sắt cần tìm là Fe2O3
Cho hỗn hợp gồm bột nhôm và oxit sắt. Thực hiện hoàn toàn phản ứng nhiệt nhôm (giả sử chỉ có phản ứng oxit sắt thành Fe) thu được hỗn hợp chất rắn B có khối lượng 19,82 g. Chia hỗn hợp thành 2 phần bằng nhau:
- Phần 1: cho tác dụng với một lượng dư dung dịch NaOH thu được 1,68 lít khí H2 (đktc).
- Phần 2: cho tác dụng với một lượng dư dung dịch HCl thì có 3,472 lít khí H2 (đktc) thoát ra.
Công thức của oxit sắt là
A. Fe2O3.
B. Fe3O4.
C. FeO.
D. Không xác định được.
Cho bột nhôm dư vào 500 ml dung dịch HCl. Phản ứng xong, thu được 16,8 lít khí H2 (đktc).
a/ Viết PTHH
b/ Tính khối lượng bột nhôm đã tham gia phản ứng
c/ Tính nồng độ mol của dung dịch HCl đã dùng
Số mol của khí hidro ở dktc
nH2 = \(\dfrac{V_{H2}}{22,4}=\dfrac{16,8}{22,4}=0,75\left(mol\right)\)
a) Pt : 2Al +6HCl → 2AlCl3 + 3H2\(|\)
2 6 2 3
0,5 1,5 0,75
a) Số mol của nhôm
nAl = \(\dfrac{0,75.2}{3}=0,5\left(mol\right)\)
Khối lượng của nhôm
mAl = nAl . MAl
= 0,5 .27
= 13,5 (g)
c) Số mol của dung dịch axit clohidric
nHCl = \(\dfrac{0,5.6}{2}=1,5\left(mol\right)\)
500ml = 0,5l
Nồng độ mol của dung dịch axit clohdric đã dùng
CMHCl = \(\dfrac{n}{V}=\dfrac{1,5}{0,5}=3\left(M\right)\)
Chúc bạn học tốt
2Al+6HCl->2AlCL3+3H2
=>nAl=\(\dfrac{2}{3}\)nH2=\(\dfrac{2}{3}\).16,8/22.4=0,5mol
=>mAl=27.0,5=13,5g
=>nHCl=2nH2=2.16,8/22,4=1,5mol
\(=>Cm=\dfrac{1,5}{\dfrac{500}{1000}}=3M\)
Để xác định thành phần phần trăm khối lượng của hỗn hợp A gồm bột nhôm và bột magie, người ta thực hiện hai thí nghiệm sau:
– Thí nghiệm 1: cho m gam hỗn hợp A tác dụng hết với dung dịch HCl loãng dư, thu được 5,6 lít khí ở đktc.
– Thí nghiệm 2: cho m gam hỗn hợp A tác dụng với dung dịch NaOH dư, thu được 3,36 lít khí ở đktc. Tính phần trăm khối lượng của mỗi chất trong hỗn hợp A.
Gọi số mol của Al và Fe lần lượt là a và b
Ta có 1,5a + b = 0,25
1,5a = 0,15
=> a = 0,1 và b = 0,1
=> %Al = 32,53%
%Fe= 67,47%