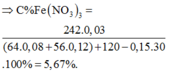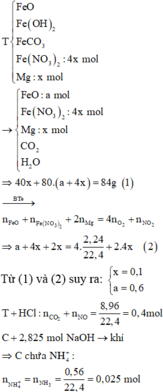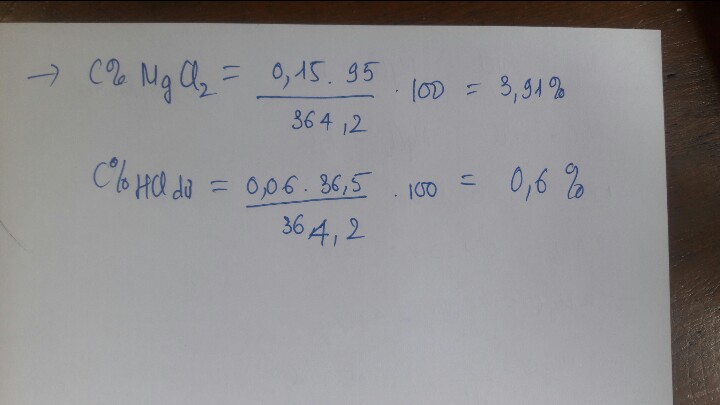Đốt hỗn hợp gồm 3,36 lít khí H2 và 2,24 lít C l 2 trong bình kín. Cho sản phẩm qua 92,7g dung dịch HCl 3,65%. Tính C% của dung dịch HCl sau cùng. (các khí đo ở đktc, H=1, Cl=35,5)

Những câu hỏi liên quan
Đốt hỗn hợp gồm 3,36 lít khí H2 và 2,24 lít Cl2 trong bình kín (khí đo ở đktc). Cho sản phẩm qua 92,7g dung dịch HCl 3,65%. Tính C% của dung dịch HCl sau phản ứng?
n(H2) = 0,15; n(Cl2) = 0,1 => H2 dư
=> n(HCl) = 2n(Cl2) = 0,2
m(ct) = 0,2.36,5 + 92,7.3,65% ~ 10,68 g
m(dd) = 0,2.36,5 + 92,7 = 100 g
=> C% = 10,68/100 = 10,68%
Đúng 0
Bình luận (0)
n(H2) = 0,15; n(Cl2) = 0,1 => H2 dư
=> n(HCl) = 2n(Cl2) = 0,2
m(ct) = 0,2.36,5 + 92,7.3,65% ~ 10,68 g
m(dd) = 0,2.36,5 + 92,7 = 100 g
=> C% = 10,68/100 = 10,68%
Đúng 0
Bình luận (0)
n(H2) = 0,15; n(Cl2) = 0,1 => H2 dư
=> n(HCl) = 2n(Cl2) = 0,2
m(ct) = 0,2.36,5 + 92,7.3,65% ~ 10,68 g
m(dd) = 0,2.36,5 + 92,7 = 100 g
=> C% = 10,68/100 = 10,68%
Đúng 0
Bình luận (0)
Câu 5: Cho 8,4 gam hỗn hợp X gồm Mg và MgO phản ứng vừa đủ với m gam dung dịch HCl 3,65 %, sau phản ứng thu được dung dịch Y và 2,24 lít khí H2 (ở đktc). a.Viết PTPƯ xảy ra và tính phần trăm khối lượng mỗi chất trong hỗn hợp đầu. b. Tính m và nồng độ phần trăm các chất trong dung dịch Y.
Câu 5 :
\(n_{H2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
a) Pt : \(Mg+2HCl\rightarrow MgCl_2+H_2|\)
1 2 1 1
0,1 0,2 0,1 0,1
\(MgO+2HCl\rightarrow MgCl_2+H_2O|\)
1 2 1 1
0,15 0,3 0,15
a) \(n_{Mg}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
\(m_{Mg}=0,1.24=2,4\left(g\right)\)
\(m_{MgO}=8,4-2,4=6\left(g\right)\)
0/0Mg = \(\dfrac{2,4.100}{8,4}=28,57\)0/0
0/0MgO = \(\dfrac{6.100}{8,4}=71,43\)0/0
b) Có : \(m_{MgO}=6\left(g\right)\)
\(n_{MgO}=\dfrac{6}{40}=0,15\left(mol\right)\)
\(n_{HCl\left(tổng\right)}=0,2+0,3=0,5\left(mol\right)\)
\(m_{HCl}=0,5.36,5=18,25\left(g\right)\)
\(m_{ddHCl}=\dfrac{18,25.100}{3,65}=500\left(g\right)\)
\(n_{MgCl2\left(tổng\right)}=0,1+0,15=0,25\left(mol\right)\)
⇒ \(m_{MgCl2}=0,15.95=14,25\left(g\right)\)
\(m_{ddspu}=8,4+500-\left(0,1.2\right)=508,2\left(g\right)\)
\(C_{MgCl2}=\dfrac{14,25.100}{508,2}=2,8\)0/0
Chúc bạn học tốt
Đúng 1
Bình luận (1)
Đốt cháy m gam hỗn hợp X gồm Cu và Fe trong 2,912 lít (đktc) hỗn hợp khí gồm Cl2 và O2 thu được (m + 6,11) gam hỗn hợp Y gồm các muối và oxit (không thấy khí thoát ra). Hòa tan hết Y trong dung dịch HCl, đun nóng thu được dung dịch Z chứa 2 muối. Cho AgNO3 dư vào dung dịch Z thu được 73,23 gam kết tủa. Mặt khác hòa tan hết m gam hỗn hợp X trên trong dung dịch HNO3 31,5% thu được dung dịch T và 3,36 lít khí NO (sản phẩm khử duy nhất, đktc). Nồng độ C% của Fe(NO3) trong dung dịch T là A. 4,63%. B...
Đọc tiếp
Đốt cháy m gam hỗn hợp X gồm Cu và Fe trong 2,912 lít (đktc) hỗn hợp khí gồm Cl2 và O2 thu được (m + 6,11) gam hỗn hợp Y gồm các muối và oxit (không thấy khí thoát ra). Hòa tan hết Y trong dung dịch HCl, đun nóng thu được dung dịch Z chứa 2 muối. Cho AgNO3 dư vào dung dịch Z thu được 73,23 gam kết tủa. Mặt khác hòa tan hết m gam hỗn hợp X trên trong dung dịch HNO3 31,5% thu được dung dịch T và 3,36 lít khí NO (sản phẩm khử duy nhất, đktc). Nồng độ C% của Fe(NO3) trong dung dịch T là
A. 4,63%.
B. 5,18%.
C. 5,48%.
D. 5,67%.
Đốt cháy m gam hỗn hợp X gồm Cu và Fe trong 2,912 lít (đktc) hỗn hợp khí gồm Cl2 và O2 thu được (m + 6,11) gam hỗn hợp Y gồm các muối và oxit (không thấy khí thoát ra). Hòa tan hết Y trong dung dịch HCl, đun nóng thu được dung dịch Z chỉ chứa 2 muối. Cho AgNO3 dư vào dung dịch Z thu được 73,23 gam kết tủa. Mặt khác hòa tan hết m gam hỗn hợp X trên trong dung dịch HNO3 31,5% thu được dung dịch T và 3,36 lít khí NO (sản phẩm khử duy nhất; đktc). Nồng độ C% của Fe(NO3)3 có trong dung dịch T gần nhấ...
Đọc tiếp
Đốt cháy m gam hỗn hợp X gồm Cu và Fe trong 2,912 lít (đktc) hỗn hợp khí gồm Cl2 và O2 thu được (m + 6,11) gam hỗn hợp Y gồm các muối và oxit (không thấy khí thoát ra). Hòa tan hết Y trong dung dịch HCl, đun nóng thu được dung dịch Z chỉ chứa 2 muối. Cho AgNO3 dư vào dung dịch Z thu được 73,23 gam kết tủa. Mặt khác hòa tan hết m gam hỗn hợp X trên trong dung dịch HNO3 31,5% thu được dung dịch T và 3,36 lít khí NO (sản phẩm khử duy nhất; đktc). Nồng độ C% của Fe(NO3)3 có trong dung dịch T gần nhất với giá trị nào sau đây ?
A. 8%
B. 5%
C. 7%
D. 9%
Đáp án B
Lời giải chi tiết
Có m(hh khí) = 6,11; n(hh khí) = 0,13
=> n(Cl2) = 0,05; n(O2) = 0,08.
Hòa tan hết Y trong HCl nên có: n(HCl) = 2.n(H2O) = 2.n(O2-) = 0,32 mol
- BTNT (Cl):
n(Cl- trong Z) = n(AgCl) = n(HCl) + n(Cl-) = 0,32 + 0,1 = 0,42. → m(AgCl) = 0,42.143,5 = 60,27 gam
→ m(kết tủa) = m(AgCl) + m(Ag) → m(Ag) = 73,23 – 60,27 = 12,96 → n(Ag) = 0,12 mol.
=> n(Fe2+) = 0,12.
BTĐT trong Z: 2.0,12 + 2.n(Cu) = 0,42 => n(Cu) = 0,09.
Vậy X chứa Fe (0,12) và Cu(0,09).
Khi X tác dụng HNO3, ta thấy: (0,12 × 3 + 0,09 × 2) ÷ 3 = 0,18 mol > n(NO) = 0,15 mol
có nghĩa là Fe không lên hết Fe3+ mà có 1 phần chỉ lên Fe2+
Khi phản ứng với HNO3: nFe(III) = a mol ; nFe(II) = bmol. ta có hệ:
a + b = 0,12
3a + 2b + 0,09.2 = 0,15.3
Giải hệ: a = 0,03; b = 0,09.
Vì HNO3 dùng hết, n(HNO3) = 4n(NO) = 0,6 mol → m(HNO3) = 37,8 → m(dd HNO3) = 120 gam.
→ BTKL: m(dd T) = m(X) + m(HNO3) – m(NO) = 127,98 gam.
C%(Fe(NO3)3 trong T) = 0,03 . 242 : 127,98 ≈ 5,67%.
Đúng 0
Bình luận (0)
Đốt cháy m gam hỗn hợp X gồm Cu và Fe trong 2,912 lít (đktc) hỗn hợp khí gồm Cl2 và O2 thu được (m + 6,11) gam hỗn hợp Y gồm các muối và oxit (không thấy khí thoát ra). Hòa tan hết Y trong dung dịch HCl, đun nóng thu được dung dịch Z chỉ chứa 2 muối. Cho AgNO3 dư vào dung dịch Z thu được 73,23 gam kết tủa. Mặt khác hòa tan hết m gam hỗn hợp X trên trong dung dịch HNO3 31,5% thu được dung dịch T và 3,36 lít khí NO (sản phẩm khử duy nhất; đktc). Nồng độ C% của Fe(NO3)3 có trong dung dịch T gần nhấ...
Đọc tiếp
Đốt cháy m gam hỗn hợp X gồm Cu và Fe trong 2,912 lít (đktc) hỗn hợp khí gồm Cl2 và O2 thu được (m + 6,11) gam hỗn hợp Y gồm các muối và oxit (không thấy khí thoát ra). Hòa tan hết Y trong dung dịch HCl, đun nóng thu được dung dịch Z chỉ chứa 2 muối. Cho AgNO3 dư vào dung dịch Z thu được 73,23 gam kết tủa. Mặt khác hòa tan hết m gam hỗn hợp X trên trong dung dịch HNO3 31,5% thu được dung dịch T và 3,36 lít khí NO (sản phẩm khử duy nhất; đktc). Nồng độ C% của Fe(NO3)3 có trong dung dịch T gần nhất với giá trị nào sau đây?
A. 8%
B. 5%
C. 7%
D. 9%
Đáp án B
Có m h h k h í = 6,11; n h h k h í = 0,13
=> n C l 2 = 0,05; n O 2 = 0,08.
Hòa tan hết Y trong HCl nên có: n H C l = 2. n H 2 O = 2. n O 2 - = 0,32 mol
- BTNT (Cl):
n C l - t r o n g Z = n A g C l = n H C l + n C l - = 0,32 + 0,1 = 0,42. → m A g C l = 0,42.143,5 = 60,27 gam
→ m k ế t t ủ a = m A g C l + m A g → m A g = 73,23 – 60,27 = 12,96 → n A g = 0,12 mol.
=> n F e 2 + = 0,12.
BTĐT trong Z: 2.0,12 + 2. n C u = 0,42 => n C u = 0,09.
Vậy X chứa Fe (0,12) và Cu(0,09).
Khi X tác dụng HNO3, ta thấy: (0,12 × 3 + 0,09 × 2) ÷ 3 = 0,18 mol > n N O = 0,15 mol
có nghĩa là Fe không lên hết Fe3+ mà có 1 phần chỉ lên Fe2+
Khi phản ứng với HNO3: nFe(III) = a mol ; nFe(II) = bmol. ta có hệ:
a + b = 0,12
3a + 2b + 0,09.2 = 0,15.3
Giải hệ: a = 0,03; b = 0,09.
Vì HNO3 dùng hết, n H N O 3 = 4 n N O = 0,6 mol → m H N O 3 = 37,8 → m d d H N O 3 = 120 gam.
→ BTKL: m d d T = m X + m H N O 3 - m N O = 127,98 gam.
% C F e ( N O 3 ) 3 t r o n g T = 0,03 . 242 : 127,98 ≈ 5,67%.
Đúng 0
Bình luận (0)
Đốt chat m gam hỗn hợp X gồm Cu và Fe trong 2,912 lít (đktc) hỗn hợp khí gồm Cl2 và O2 thu được (m + 6,11) gam hỗn hợp Y gồm các muối và oxit (không thấy khí thoát ra). Hòa tan hết Y trong dung dịch HCl, đun nóng thu được dung dịch Z chứa 2 muối. Cho AgNO3 dư vào dung dịch Z thu được 73,23 gam kết tủa. Mặt khác hòa tan hết m gam hỗn hợp X trên vào dung dịch HNO3 31,5% thu được dung dịch T và 3,36 lít khí NO (sản phẩm khử duy nhất; đktc). Nồng độ C% của Fe(NO3)3 có trong dung dịch T gần đúng nhất...
Đọc tiếp
Đốt chat m gam hỗn hợp X gồm Cu và Fe trong 2,912 lít (đktc) hỗn hợp khí gồm Cl2 và O2 thu được (m + 6,11) gam hỗn hợp Y gồm các muối và oxit (không thấy khí thoát ra). Hòa tan hết Y trong dung dịch HCl, đun nóng thu được dung dịch Z chứa 2 muối. Cho AgNO3 dư vào dung dịch Z thu được 73,23 gam kết tủa. Mặt khác hòa tan hết m gam hỗn hợp X trên vào dung dịch HNO3 31,5% thu được dung dịch T và 3,36 lít khí NO (sản phẩm khử duy nhất; đktc). Nồng độ C% của Fe(NO3)3 có trong dung dịch T gần đúng nhất với:
A. 5%
B. 7%
C. 8%
D. 9%
Đáp án A
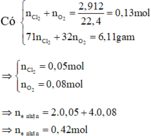
Y + HCl => Z chỉ chứa hai muối, HCl phản ứng hết
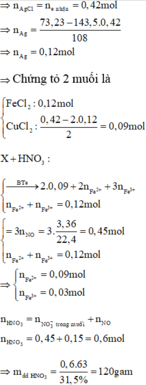
⇒ m dd T = 120 + 64 . 0 , 09 + 56 . 0 , 12 - 30 . 0 , 15 = 127 , 98 gam ⇒ C % Fe NO 3 3 = 242 . 0 , 03 127 , 98 . 100 % = 5 , 67 %
gần với giá trị 5% nhất
Đúng 0
Bình luận (0)
Nung m gam hỗn hợp T gồm FeO, Fe(OH)2, FeCO3, Fe(NO3)2 (4x mol) và Mg (x mol) trong bình kín có chứa 2,24 lít khí O2. Sau khi phản ứng xảy ra hoàn toàn, thu được 84 gam hỗn hợp rắn X gồm MgO, Fe2O3 và hỗn hợp Y gồm 3 khí và hơi. Cho m gam T tác dụng với dung dịch HCl vừa đủ, thu được dung dịch C và 8,96 lít hỗn hợp khí gồm NO và CO2. Cho C tác dụng vừa đủ với dung dịch chứa 2,825 mol NaOH, thu được 0,56 lít khí duy nhất. Phần trăm số mol của FeCO3 trong T là A. 17,17%. B. 18,18%. C. 19,19%. D...
Đọc tiếp
Nung m gam hỗn hợp T gồm FeO, Fe(OH)2, FeCO3, Fe(NO3)2 (4x mol) và Mg (x mol) trong bình kín có chứa 2,24 lít khí O2. Sau khi phản ứng xảy ra hoàn toàn, thu được 84 gam hỗn hợp rắn X gồm MgO, Fe2O3 và hỗn hợp Y gồm 3 khí và hơi. Cho m gam T tác dụng với dung dịch HCl vừa đủ, thu được dung dịch C và 8,96 lít hỗn hợp khí gồm NO và CO2. Cho C tác dụng vừa đủ với dung dịch chứa 2,825 mol NaOH, thu được 0,56 lít khí duy nhất. Phần trăm số mol của FeCO3 trong T là
A. 17,17%.
B. 18,18%.
C. 19,19%.
D. 20,20%.
Cho 4,4 gam hỗn hợp X gồm Mg và MgO tác dụng với dung dịch HCl 3,65% (dư 20% so với lượng phản ứng) thu được dung dịch Y và 2,24 lít khí H2 (đktc). (a) Viết PTHH xảy ra và tính phần trăm khối lượng mỗi chất trong hỗn hợp X. (b) Tính nồng độ phần trăm các chất có trong dung dịch Y.
Cho 3,36 lít ( đktc ) hỗn hợp Y gồm axetilen và metan đi qua bình đựng dung dịch Br2 dư, sau phản ứng thấy thoát ra 2,24 lít khí ( đktc ). a. Viết phương trình phản ứng. b. Tính số mol mỗi khí trong hỗn hợp. c. Tính % về khối lượng từng khí trong hỗn hợp.
Cứu với! Mình hiện đang rất cần gấp!!
a. Phương trình phản ứng giữa axetilen và dung dịch Br2:
C2H2 + Br2 → C2H2Br2
b. Theo định luật Avogadro, số mol khí thể tích bằng nhau ở cùng điều kiện nhiệt độ và áp suất. Vì vậy, số mol của hỗn hợp Y bằng số mol của khí thoát ra sau phản ứng.
Theo đó, ta có thể tính số mol mỗi khí trong hỗn hợp:
Số mol khí thoát ra: n = V/ Vm = 2,24/ 22,4 = 0,1 molSố mol axetilen ban đầu: n(C2H2) = n = 0,1 molSố mol metan ban đầu: n(CH4) = (V(Y) - V(C2H2)) / Vm = (3,36 - 2,24) / 22,4 = 0,05 molc. Để tính % về khối lượng từng khí trong hỗn hợp, ta cần biết khối lượng riêng của từng khí. Ở đktc, khối lượng riêng của axetilen là 1,096 g/L và khối lượng riêng của metan là 0,717 g/L.
Khối lượng axetilen trong hỗn hợp: m(C2H2) = n(C2H2) x M(C2H2) = 0,1 x 26 = 2,6 gKhối lượng metan trong hỗn hợp: m(CH4) = n(CH4) x M(CH4) = 0,05 x 16 = 0,8 gTổng khối lượng của hỗn hợp Y: m(Y) = V(Y) x ρ(Y) = 3,36 x 1,25 = 4,2 gVậy, % về khối lượng của axetilen trong hỗn hợp là:
% m(C2H2) = (m(C2H2) / m(Y)) x 100% = (2,6 / 4,2) x 100% = 61,9%
% về khối lượng của metan trong hỗn hợp là:
% m(CH4) = (m(CH4) / m(Y)) x 100% = (0,8 / 4,2) x 100% = 19,0%
Đúng 2
Bình luận (0)