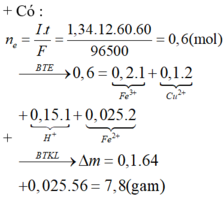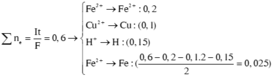Điện phân với điện cực trơ dung dịch chứa 0,2 mol C u N O 3 2 , cường độ dòng điện 2,68A, trong thời gian t (giờ), thu được dung dịch X. Cho 14,4 gam bột Fe vào X, thu được khí NO (sản phẩm khử duy nhất của N + 5 ) và 13,5 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn và hiệu suất của quá trình điện phân là 100%. Giá trị của t là
A. 1,00.
B. 1,20.
C. 0,60.
D. 0,25.