Trong phòng thí nghiệm, người ta dùng hiđro để khử sắt(III) oxit và thu được 11,2 gam sắt.
Viết phản ứng hóa học xảy ra.
Tính khối lượng sắt(III) oxit đã phản ứng.
Tính thể tích khí hiđro đã tiêu thụ (đktc).
:Trong phòng thí nghiệm người ta dùng khí hiđro để khử sắt(III) oxit và thu được 11,2 gam Fe. a) Viết phương trình hóa học của phản ứng đã xảy ra.
b) Tính khối lượng sắt(III) oxit đã phản ứng.
c) Tính thể tích khí hiđro đã tiêu thụ (ở đktc).
a, \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
b, \(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
Theo PT: \(n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe}=0,1\left(mol\right)\Rightarrow m_{Fe_2O_3}=0,1.160=16\left(g\right)\)
c, Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Fe}=0,3\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,3.22,4=6,72\left(l\right)\)
Trong phòng thí nghiệm người ta dùng khí hiđro để khử sắt(II) oxit và thu được 11,2 g Fe.
a) Viết phương trình hóa học của phản ứng đã xảy ra.
b) Tính khối lượng sắt (III) oxit đã phản ứng.
c) Tính thể tích khí hiđro đã tiêu thụ (đktc).
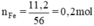
Phương trình hóa học của phản ứng:
Fe2O3 + 3H2 → 2Fe + 3H2O.
Khử 1 mol Fe2O3 cho 2 mol Fe.
x mol Fe2O3 → 0,2 mol.
x = 0,2 : 2 =0,1 mol.
m = 0,1 .160 =16g.
Khử 1 mol Fe2O3 cần 3 mol H2.
Vậy khử 0,1 mol Fe2O3 cần 0,3 mol H2.
V= 0,3 .22.4 = 6,72l.
Trong phòng thí nghiệm, người ta dùng hidro để khử sắt (III) oxit và thu được 11,2 gam sắt.
Viết phương trình hoá học của phản ứng đã xảy ra.
Tính khối lượng sắt(III) oxit đã phản ứng.
Tính thể tích khí hidro đã tiêu thụ (ở đktc).
Trong phòng thí nghiệm người ta dùng hiđro để khử sắt (III) oxi và thu được 12,6 g sắt.
a. Tính khối lượng sắt (III) oxit đã phản ứng;
b. Tính thể tích khí hiđro đã tiêu thụ (ở đktc).
Fe2O3+3H2-to>2Fe+3H2O
0,1125---0,3375----0,225 mol
n Fe=0,225 mol
=>m Fe2O3=0,1125.160=18g
=>VH2=0,3375.22,4=7,56l
a,\(n_{Fe}=\dfrac{12,6}{56}=0,225\left(mol\right)\)
PTHH: 3H2 + Fe2O3 ---to---> 2Fe + 3H2O
Mol: 0,3375 0,1125
\(m_{Fe_2O_3}=0,1125.160=18\left(g\right)\)
b, \(V0,3375.22,4=7,56\left(l\right)\)
Trong phòng thí nghiệm ,người ta dùng hiđro để khử sắt(III)oxit(Fe2O3) thu được 24 gam sắt. a. Viết phương trình hóa học của phản ứng xảy ra b.tính số gam sắt(III)oxit đã phản ứng c. tính thể tích khí hiđro dùng để khử(ở đktc)
a, \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
b, \(n_{Fe}=\dfrac{24}{56}=\dfrac{3}{7}\left(mol\right)\)
Theo PT: \(n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe}=\dfrac{3}{14}\left(mol\right)\Rightarrow m_{Fe_2O_3}=\dfrac{3}{14}.160=\dfrac{240}{7}\left(g\right)\)
c, Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Fe}=\dfrac{9}{14}\left(mol\right)\Rightarrow V_{H_2}=\dfrac{9}{14}.22,4=14,4\left(l\right)\)
\(n_{Fe}=\dfrac{m}{M}=\dfrac{24}{56}\approx0,43\left(mol\right)\\ a.PTHH:Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
2 3 2 3
0,43 0,645 0,45 0,645
\(b.m_{Fe_2O_3}=n.M=0,43.\left(56.2+16.3\right)=68,8\left(g\right)\\ c.V_{H_2}=n.24,79=0,645.24,79=15,98955\left(l\right).\)
a)\(PTHH:Fe_3O_4+4H_2\xrightarrow[]{}3Fe+4H_2O\)
b)\(m_{Fe}=\dfrac{24}{56}=0,4\left(m\right)\)
\(PTHH:Fe_3O_4+4H_2\xrightarrow[]{}3Fe+4H_2O\)
tỉ lệ :1 4 3 4
số mol :0,13 0,53 0,4 0,53
\(m_{Fe_3O_4}=0,13.232=30,16\left(g\right)\)
c)\(V_{H_2}=0,53.22,4=11,872\left(l\right)\)
trong phòng thí nghiệm người ta dùng khí H2 để khử sắt III oxit và thu đc 11.2 g sắt
a, viết phương trình hóa học của phản ứng xảy ra.
b, Tính khối lượng sắt III oxit đã phản ứng
c, tính thể tích khí H2 đã tiêu thụ ở dktc
nFe=0,2(mol)
a) PTHH: Fe2O3 + 3 H2 -to-> 2 Fe + 3 H2O
0,1_____________0,3____0,2(mol)
b) mFe2O3=160.0,1=16(g)
c) V(H2,đktc)=0,3.22,4=6,72(l)
nFe = 11.2/56 = 0.2 (mol)
FeO + H2 -to-> Fe + H2O
0.2.....0.2...........0.2
mFeO = 0.2*72 = 14.4 (g)
VH2 = 0.2*22.4 = 4.48 (l)
Câu 2: Trong phòng thí nghiệm, người ta dùng hiđro khử sắt (lll) oxit và thu được 11,2g sắt.
a.Viết phương trình hóa học của phản ứng đã xảy ra.
b.Tính khối lượng sắt (lll) oxit đã phản ứng.
c.Tính thể tích hiđro đã tiêu thụ (ở điều kiện tiêu chuẩn). [Fe=56;O=16;H=1]
a) Fe2O3 + 3H2 --to--> 2Fe + 3H2O
b) \(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
PTHH: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
0,1<---0,3<-----0,2
=> mFe2O3 = 0,1.160 = 16 (g)
c) VH2 = 0,3.22,4 = 6,72 (l)
cau10 Trong phòng thí nghiệm, người ta dùng hiđro để khử sắt (III) oxit và thu được 11,2g sắt. Tinh khối lượng sắt (III) oxit đã phản ứng?
Số mol của sắt
nFe = \(\dfrac{m_{Fe}}{M_{Fe}}=\dfrac{11,2}{56}=0,2\) (mol)
Pt : Fe2O3 + 3H2 \(\rightarrow\) 2Fe + 3H2O\(|\)
1 2 2 2
0,1 0,2
Số mol của sắt (III) oxit
nFe2O3 = \(\dfrac{0,2.1}{2}=0,1\) (mol)
Khối lượng của sắt (III) oxit
mFe2O3 = nFe2O3 . MFe2O3
= 0,1 . 160
= 16 (g)
Chúc bạn học tốt
Trong phòng thí nghiệm, người ta dùng khí hiđro để khử sắt (III) oxit Fe2O3 và thu được 11,2 gam sắt. Tính khối lượng Fe2O3 đã bị khử
\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
\(PTHH:Fe_2O_3+3H_2\xrightarrow[]{}2Fe+3H_2O\)
tỉ lệ :1 3 2 3
số mol :0,1 0,3 0,2 0,3
\(m_{Fe_2O_3}=0,1.160=16\left(g\right)\)
\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
\(Fe_2O_3+3H_2\xrightarrow[]{t^\circ}2Fe+3H_2O\uparrow\)
0,1 ← 0,2
\(\Rightarrow m_{Fe_2O_3}=0,1\cdot160=16\left(g\right)\)
\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
PT: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
Theo PT: \(n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe}=0,1\left(mol\right)\Rightarrow m_{Fe_2O_3}=0,1.160=16\left(g\right)\)