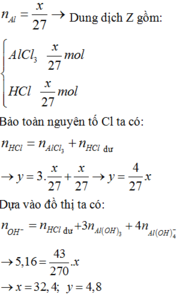Trong 500ml dung dịch Z có chứa 8,4 gam KOH. Tính nồng độ mol của dung dịch Z.

Những câu hỏi liên quan
Trong 500ml dung dịch Z có chứa 8,4 gam KOH. Phải thêm bao nhiêu ml nước vào 500ml dung dịch Z để được dung dịch KOH 0,1M?
Vì khi pha loãng dung dịch thì số mol chất tan không đổi nên:
n KOH ban đầu = n KOH lúc sau
Gọi V là thể tích dung dịch sau khi pha loãng.
Ta có: V = n / C M = 0 , 15 / 0 , 1 = 1 , 5 ( lít ) = 1500 ( ml )
Vậy thể tích nước cần thêm vào là:
1500 – 500 = 1000 (ml).
Đúng 0
Bình luận (0)
Hãy tính:
a. Số mol của KOH trong 28 gam dung dịch KOH 10%..
b. Nồng độ phần trăm của dung dịch tạo thành khi cho 36 gam đường vào 144 gam nước.
c. Nồng độ mol của dung dịch NaOH, biết rằng trong 80 ml dung dịch này có chứa 0,8 gam NaOH
\(a,m_{KOH}=\dfrac{28.10}{100}=2,8\left(g\right)\\ \rightarrow n_{KOH}=\dfrac{2,8}{56}=0,05\left(mol\right)\\ b,C\%=\dfrac{36}{144+36}.100\%=20\%\\ c, n_{NaOH}=\dfrac{0,8}{40}=0,02\left(mol\right)\\ \rightarrow C_{M\left(NaOH\right)}=\dfrac{0,02}{0,08}=0,25M\)
Đúng 1
Bình luận (0)
\(a,m_{KOH}=\dfrac{28.10}{100}=2,8\left(g\right)\\ n_{KOH}=\dfrac{2,8}{56}=0,05\left(mol\right)\\ C\%=\dfrac{36}{36+144}.100\%=20\%\\ C_M=\dfrac{0,8}{0,08}=10M\)
Đúng 3
Bình luận (0)
Hỗn hợp X gồm 0,15 mol Mg và 0,1 mol Fe cho vào 500ml dung dịch Y gồm AgNO3 và Cu(NO3)2; sau khi phản ứng xong nhận được 20 gam chất rắn Z và dung dịch E; cho dung dịch NaOH dư vào dung dịch E, lọc kết tủa nung ngoài không khí nhận được 8,4 gam hỗn hợp 2 oxit. Nồng độ mol/l của AgNO3 và Cu(NO3)2 lần lượt là A. 0,24M và 0,5M. B. 0,12M và 0,36M C. 0,12M và 0,3M. D. 0,24M và 0,6M.
Đọc tiếp
Hỗn hợp X gồm 0,15 mol Mg và 0,1 mol Fe cho vào 500ml dung dịch Y gồm AgNO3 và Cu(NO3)2; sau khi phản ứng xong nhận được 20 gam chất rắn Z và dung dịch E; cho dung dịch NaOH dư vào dung dịch E, lọc kết tủa nung ngoài không khí nhận được 8,4 gam hỗn hợp 2 oxit. Nồng độ mol/l của AgNO3 và Cu(NO3)2 lần lượt là
A. 0,24M và 0,5M.
B. 0,12M và 0,36M
C. 0,12M và 0,3M.
D. 0,24M và 0,6M.
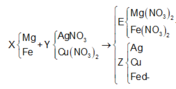
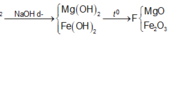
Trong F có 0,15 mol MgO và x mol Fe2O3 nên
0,1540 +x.160 = 8,4 ⇔ x = 0,015
nFe phản ứng = = 0,03
nFe dư = 0,1 – 0,03 = 0,07.
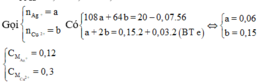
Đáp án C
Đúng 0
Bình luận (0)
cho 8,4 gam CaCO3 tác dụng với 500ml dung dịch H2SO4 1M đến khi phản ứng xảy ra hoàn toàn. tính nồng độ mol của các chất trong dung dịch sau phản ứng ( coi thể tích dung dịch sau phản ứng vẫn là 500 ml).
nCaCO3=8,4:(40+12+16.3)=0,084 mol
nH2SO4= 0,5.1=0,5 mol
PTHH: H2SO4+ CaCO3 --> CaSO4↓ + CO2 +H2O
theo đề: 0,5 mol: 0,084 mol
=> H2SO4 de theo CaCO3
phản ứng : 0,084mol<----0,084 mol---> 0,084mol
=> CM=\(\frac{0,084}{0,5}=0,168M\)
Đúng 0
Bình luận (0)
Cho 8,96l H2S(đktc)+ 500ml dung dịch KOH 1M thu được dung dịch A. Tính nồng độ mol/l các chất có trong dung dịch A
Cho a gam Al tan hoàn toàn vào dung dịch chứa x mol HCl thu được dung dịch Z chứa 2 chất tan có cùng nồng độ mol. Thêm từ từ dung dịch chứa 16,88 gam NaOH vào dung dịch Z thì kết tủa thu được là 15,21x gam. Giá trị của a gần nhất với: A. 2,8 B. 2,9 C. 2,71 D. 3,2
Đọc tiếp
Cho a gam Al tan hoàn toàn vào dung dịch chứa x mol HCl thu được dung dịch Z chứa 2 chất tan có cùng nồng độ mol. Thêm từ từ dung dịch chứa 16,88 gam NaOH vào dung dịch Z thì kết tủa thu được là 15,21x gam. Giá trị của a gần nhất với:
A. 2,8
B. 2,9
C. 2,71
D. 3,2
Cho x gam Al tan hoàn toàn trong dung dịch chứa y mol HCl thu được dung dịch Z chứa 2 chất có cùng nồng độ mol. Thêm từ từ dung dịch NaOH vào dung dịch Z thì đồ thị biểu diễn lượng kết tủa phụ thuộc vào lượng OH- như sau: Giá trị của x là A. 27,0 B. 26,1 C. 32,4 D. 20,25
Đọc tiếp
Cho x gam Al tan hoàn toàn trong dung dịch chứa y mol HCl thu được dung dịch Z chứa 2 chất có cùng nồng độ mol. Thêm từ từ dung dịch NaOH vào dung dịch Z thì đồ thị biểu diễn lượng kết tủa phụ thuộc vào lượng OH- như sau:
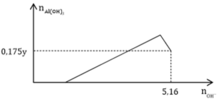
Giá trị của x là
A. 27,0
B. 26,1
C. 32,4
D. 20,25
Khi cho 100ml dung dịch KOH 1M vào 100ml dung dịch HCl thu được dung dịch có chứa 6,525 gam chất tan. Nồng độ mol của HCl trong dung dịch đã dùng là
A. 0,75M
B. 1M
C. 0,25M
D. 0,5M
Đáp án D
Gọi số mol HCl là x mol
HCl + KOH → KCl + H2O
x x (mol)
Giả sử KOH hết ⇒ mKCl = 74,5 . 0,1 = 7.45(g) > 6,525 ⇒KOH dư ,HCl hết.
(0,1 - x).56 + x.(39 + 35,5) = 6,525
⇒ x = 0,05 mol ⇒ CM = 0,5M
Đúng 0
Bình luận (0)
a) Hòa tan 7,5 gam kali hidroxit(KOH) vào 42,5 gam nước(H2O).Hãy tính nồng độ phần trăm của dung dịch b)Trong 16ml dung dịch có hòa tan1,26 gam axit nitric(HNO3).Hãy tính nồng độ mol của dung dịch.
a)
\(C\%_{dd.KOH}=\dfrac{7,5}{7,5+42,5}.100\%=15\%\)
b) \(n_{HNO_3}=\dfrac{1,26}{63}=0,02\left(mol\right)\Rightarrow C_{M\left(dd.HNO_3\right)}=\dfrac{0,02}{0,016}=1,25M\)
Đúng 1
Bình luận (0)