Cho 20 gam sắt(III) sunfat F e 2 S O 4 3 tác dụng với natri hiđroxit (NaOH) thu được 10,7 gam sắt(III) hiđroxit F e 2 S O 4 3 và 21,3 gam natri sunfat N a 2 S O 4 Tính khối lượng natri hiđroxit tham gia phản ứng.

Những câu hỏi liên quan
cho sắt (III) oxit(Fe(III) và O)tác dụng với 14,7 gam axit sunfuric (H và nhóm SO4) loãng,người ta thu được 20 gam muối sắt(III) sunfat (Fe(III và nhóm SO4) và 5,4 gam nước (H và O)
a)Lập phương trình hóa học của phản ứng
b)Viết công thức về khối lượng của phản ứng hóa học trên
c)Tính khối lượng của sắt (III)oxit đã tham gia phản ứng
\(a,Fe_2O_3+3H_2SO_4\to Fe_2(SO_4)_3+3H_2O\\ b,m_{Fe_2O_3}+m_{H_2SO_4}=m_{Fe_2(SO_4)_3}+m_{H_2O}\\ c,m_{Fe_2O_3}=20+5,4-14,7=10,7(g)\)
Đúng 1
Bình luận (0)
Cho 20 gam sắt III sunfat
F
e
2
S
O
4
3
tác dụng với natri hidroxit NaOH, thu được 10,7 gam sắt III hidroxit
F
e
(
O
H
)
3
và 21,3 gam natri sunfat
N
a
2
S
O
4
. Xác định...
Đọc tiếp
Cho 20 gam sắt III sunfat F e 2 S O 4 3 tác dụng với natri hidroxit NaOH, thu được 10,7 gam sắt III hidroxit F e ( O H ) 3 và 21,3 gam natri sunfat N a 2 S O 4 . Xác định khối lượng natri hidroxit tham gia vào phản ứng.
Sơ đồ
Sắt (III) sunfat + Natri hidroxit → Sắt (III) hidroxit + natri sunfat
Áp dụng ĐLBTKL, ta có
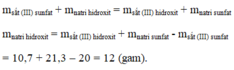
Đúng 0
Bình luận (0)
Cho 20 gam sắt(III) sunfat Fe2(SO4)3 tác dụng với natri hiđroxit NaOH, thu được 10,7 gam sắt(III) hiđroxit Fe(OH)3 và 21,3 gam natri sunfat Na2SO4. Số mol natri hiđroxit tham gia vào phản ứng là :A. 0,5 mol. B. 9,4 mol. C. 12 mol. D. 0.3 mol.
Đọc tiếp
Cho 20 gam sắt(III) sunfat Fe2(SO4)3 tác dụng với natri hiđroxit NaOH, thu được 10,7 gam sắt(III) hiđroxit Fe(OH)3 và 21,3 gam natri sunfat Na2SO4. Số mol natri hiđroxit tham gia vào phản ứng là :
A. 0,5 mol.
B. 9,4 mol.
C. 12 mol.
D. 0.3 mol.
Theo ĐLBTKL:
\(m_{Fe_2\left(SO_4\right)_3}+m_{NaOH}=m_{Fe\left(OH\right)_3}+m_{Na_2SO_4}\)
=> \(m_{NaOH}=10,7+21,3-20=12\left(g\right)=>n_{NaOH}=\dfrac{12}{40}=0,3\left(mol\right)\)
=> D
Đúng 2
Bình luận (0)
: Cho 20 gam sắt(III) sunfat [Fe2(SO4)3] tác dụng với natri hiđroxit (NaOH) thu được 10,7 gam sắt(III) hiđroxit Fe2(SO4)3 và 21,3 gam natri sunfat Na2SO4. Tính khối lượng natri hiđroxit tham gia phản ứng.
Đọc tiếp
: Cho 20 gam sắt(III) sunfat [Fe2(SO4)3] tác dụng với natri hiđroxit (NaOH) thu được 10,7 gam sắt(III) hiđroxit Fe2(SO4)3 và 21,3 gam natri sunfat Na2SO4. Tính khối lượng natri hiđroxit tham gia phản ứng.
Sắt (III) sunfat + Natri hidroxit →Sắt (III) hidroxit + natri sunfat
Áp dụng ĐLBTKL, ta có :msắt (III) sunfat + mnatri hidroxit = msắt (III) hidroxit + mnatri sunfat
mnatri hidroxit = msắt (III) hidroxit + mnatri sunfat - msắt (III) sunfat
= 10,7 + 21,3 – 20 = 12 (gam).
Những câu nào có trên mạng thì mk tham khảo nha k phải làm lai nx
Đúng 0
Bình luận (0)
PTHH: Fe2(SO4)3 + NaOH ----> Fe(OH)3↓ + Na2SO4
Theo định luật bảo toàn khối lượng và PTHH, ta có:
mFe2(SO4)3 + mNaOH = mFe(OH)3 + mNa2SO4
=> Khối lượng NaOH đã phản ứng là:
mNaOH = ( mFe(OH)3 + mNa2SO4 ) - mFe2(SO4)3
= (10,7+21,3)-20 = 12 (g)
Chúc bạn học tốt!!
Đúng 0
Bình luận (0)
Khử 16 gam sắt (III) oxit F*e_{2} * O_{3} bằng 13,44 lít khí hiđro ở đktc tạo thành sắt và hơi
nước.
a/ Viết phản ứng.
b/ Tính khối lượng sắt tạo thành?
C/ Cần dùng thêm bao nhiêu gam CuO nữa d hat e tác dụng hết lượng chất dư ở trên?
Cho biết: Fe = 56 O = 16 , H = I , Cu=56.
a.b.\(n_{Fe_2O_3}=\dfrac{m_{Fe_2O_3}}{M_{Fe_2O_3}}=\dfrac{16}{160}=0,1mol\)
\(n_{H_2}=\dfrac{V_{H_2}}{22,4}=\dfrac{13,44}{22,4}=0,6mol\)
\(Fe_2O_3+3H_2\rightarrow\left(t^o\right)2Fe+3H_2O\)
0,1 < 0,6 ( mol )
0,1 0,3 0,2 ( mol )
\(m_{Fe}=n_{Fe}.M_{Fe}=0,2.56=11,2g\)
c.\(n_{H_2}=0,6-0,3=0,3mol\)
\(CuO+H_2\rightarrow Cu+H_2O\)
0,3 0,3 ( mol )
\(m_{CuO}=n_{CuO}.M_{CuO}=0,3.80=24g\)
Đúng 3
Bình luận (0)
Cho 15,04 gam bột Cu vào cốc thủy tinh đựng dung dịch sắt III sunfat, khuấy đều cho phản ứng hoàn toàn sau đó lọc, thu đc dung dịch B và 2,24 gam chất rắn AThổi khí H2S dư vào dung dịch B, lọc kết tủa D và dung dịch E. Đun nhẹ dung dịch E để phần H2S còn dư bay đi hết, sau đó cho toàn bộ lượng chất A ở trên vào phần dung dịch và thổi khí O2 đi qua cốc đến khi các pư hoàn toàn. giả thiết muối của Fe ko tham gia pư với o2. tính số mol mỗi chất tan có trong dd sau cùng. tính số gam D
Đọc tiếp
Cho 15,04 gam bột Cu vào cốc thủy tinh đựng dung dịch sắt III sunfat, khuấy đều cho phản ứng hoàn toàn sau đó lọc, thu đc dung dịch B và 2,24 gam chất rắn A
Thổi khí H2S dư vào dung dịch B, lọc kết tủa D và dung dịch E. Đun nhẹ dung dịch E để phần H2S còn dư bay đi hết, sau đó cho toàn bộ lượng chất A ở trên vào phần dung dịch và thổi khí O2 đi qua cốc đến khi các pư hoàn toàn. giả thiết muối của Fe ko tham gia pư với o2. tính số mol mỗi chất tan có trong dd sau cùng. tính số gam D
n Cu = 15,04/64 = 0,235(mol)
n Cu dư = 2,24/64 = 0,035(mol)
=> n Cu pư = 0,235-0,035 = 0,2(mol)
$Cu + Fe_2(SO_4)_3 \to 2FeSO_4 + CuSO_4$
n FeSO4 = 0,2.2 = 0,4(mol)
n CuSO4 = 0,2(mol)
Chất rắn A : Cu dư
Dung dịch B : FeSO4,CuSO4
D : CuS
E : FeSO_4,H2SO4
$CuSO_4 + H_2S \to CuS + H_2SO_4$
n CuS = n H2SO4 = n CuSO4 = 0,2(mol)
m D = 0,2.96 = 19,2(gam)
$Cu + H_2SO_4 + \dfrac{1}{2}O_2 \to CuSO_4 + H_2O$
n Cu = 0,035 < n H2SO4 = 0,2 nên H2SO4 dư
n CuSO4 = n Cu = 0,035(mol)
n H2SO4 = 0,2 - 0,035 = 0,165(mol)
Vậy dung dịch sau cùng có :
CuSO4 : 0,035(mol)
H2SO4 : 0,165(mol)
FeSO4 = 0,4(mol)
Đúng 1
Bình luận (2)
Tính số mol trong hợp chất sau:
300 gam sắt (III) sunfat F e 2 S O 4 3
Tính số mol trong lượng chất:
300 gam F e 2 S O 4 3 : n = m/M= 300/400 = 0,75 (mol)
Đúng 0
Bình luận (0)
viết các cthh có tên gọi
1. cacbon dioxit 15. sắt(III) oxit
2. axit sunfuric 16. sắt(II) oxit
3 kali sunfat 17. sắt(II) clorua
4. natri nitrat 18. sắt(II) nitrat
5. kẽm hidroxit 19. sắt(III) hidroxit
6. đồng (II) sùnat...
Đọc tiếp
viết các cthh có tên gọi
1. cacbon dioxit 15. sắt(III) oxit
2. axit sunfuric 16. sắt(II) oxit
3 kali sunfat 17. sắt(II) clorua
4. natri nitrat 18. sắt(II) nitrat
5. kẽm hidroxit 19. sắt(III) hidroxit
6. đồng (II) sùnat 20.axit sunfuric
7. canxi hidroxit 21.oxit sắt từ
8. bạc nitrat 22.nhôm oxit
9.bari sunfat 23.nhôm clorua
10. chì phot pha 24.nhôm sunfat
11. axit phot phoric 25.nhôm cacbonat
12. kẽm clorua 26.nhôm hidroxit
13. natri nitrit 27.sắt(II)hidroxit
14. sắt (III) nitrat 28. kali hidroxi sunfat
viết các cthh có tên gọi
1. cacbon dioxit: CO2 15. sắt(III) oxit: Fe2O3
2. axit sunfuric: H2SO4 16. sắt(II) oxit: FeO
3 kali sunfat: K2SO4 17. sắt(II) clorua: FeCl2
4. natri nitrat: NaNO3 18. sắt(II) nitrat: Fe(NO3)2
5. kẽm hidroxit: Zn(OH)2 19. sắt(III) hidroxit: Fe(OH)3
6. đồng (II) sùnat: Cu(OH)2 20.axit sunfuric: H2SO4
7. canxi hidroxit: Ca(OH)2 21.oxit sắt từ: Fe3O4
8. bạc nitrat: AgNO3 22.nhôm oxit: Al2O3
9.bari sunfat: BaSO4 23.nhôm clorua: AlCl3
10. chì phot pha: Pb3(PO4)2 24.nhôm sunfat Al2(SO4)3
11. axit phot phoric: H3PO4 25.nhôm cacbonat: Al2(CO3)3
12. kẽm clorua: ZnCl2 26.nhôm hidroxit: Al(OH)3
13. natri nitrit: NaNO2 27.sắt(II)hidroxit: Fe(OH)2
14. sắt (III) nitrat: Fe(NO3)3 28. kali hidroxi sunfat: KHSO4
Đúng 0
Bình luận (0)
1. CO2 15. Fe2O3
2. H2SO4 16. FeO
3 K2SO4 17. FeCl2
4. NaNO3 18. Fe(NO3)2
5. Zn(OH)2 19. Fe(OH)3
6. CuSO4 20.H2SO4
7. Ca(OH)2 21.Fe3O4
8. AgNO3 22. Al2O3
9.Ag2SO4 23.AlCl3
Đúng 0
Bình luận (3)
Ngâm một lá sắt trong 100g dung dịch đồng (III) sunfat 3,2% cho đến khi sắt ko tan đc nữa.
a) Tính khối lượng sắt phản ứng
b) Tính nồng độ % của chất trong dung dịch thu đc sau phản ứng
(biết Fe = 56; Cu = 64; S = 32; O = 16)
a) \(n_{CuSO_4}=\dfrac{100.3,2\%}{160}=0,02\left(mol\right)\)
PTHH: CuSO4 + Fe ---> FeSO4 + Cu
0,02---->0,02--->0,02----->0,02
=> mFe (pư) = 0,02.56 = 1,12 (g)
b) mdd sau pư = 100 + 1,12 - 0,02.64 = 99,84 (g)
=> \(C\%_{FeSO_4}=\dfrac{0,02.152}{99,84}.100\%=3,045\%\)
Đúng 2
Bình luận (0)






















