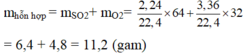Tính khối lượng của một hỗn hợp khí (X) ở đktc gồm 2,24l S O 2 và 3,36 lít O 2

Những câu hỏi liên quan
Tính khối lượng của hỗn hợp khí ở đktc gồm 2,24 lít S O 2 và 3,36 lít O 2
a) Tính khối lượng của : 0,5mol nguyên tử Al ; 6,72 lít khí CO2(đktc); 5,6 lít khí N2 ( ở đktc); 0,25 mol phân tử CaCO3.
b) Tính khối lượng của hỗn hợp gồm: 3,36 lít khí H2( đktc) và 5,6 lít khí N2(đktc); 0,2 mol CO2.
a.
\(m_{Al}=0.5\cdot27=13.5\left(g\right)\)
\(m_{CO_2}=\dfrac{6.72}{22.4}\cdot44=13.2\left(g\right)\)
\(m_{N_2}=\dfrac{5.6}{22.4}\cdot28=7\left(g\right)\)
\(m_{CaCO_3}=0.25\cdot100=25\left(g\right)\)
b.
\(m_{hh}=\dfrac{3.36}{22.4}\cdot2+\dfrac{5.6}{22.4}\cdot28+0.2\cdot44=16.1\left(g\right)\)
Đúng 3
Bình luận (1)
Câu1: 10g hỗn hợp X gồm Na và Na₂O tác dụng hoàn toàn với nước thu đc 2 lít dd A và 3,36 lít khí H₂ (đktc)
a) Viết các PTHH xảy ra
b) Tính % khối lượng các chất có trong hỗn hợp X
c) Tính nồng độ mol/lít của dd A
Câu 2: Cho 7,2g kim loại hóa trị II phản ứng hoàn toàn với 100ml dd HCl 6M. Tìm tên kim loại.
Tính khối lượng của 1 hỗn hợp khí ở đktc gồm 2,24 lít SO2 và 3,36 lít O2
\(n_{SO_2}=\frac{V_{SO_2}}{22,4}=\frac{2,24}{22,4}=0,1\left(mol\right)\)
\(=>m_{SO_2}=n_{SO_2}.M_{SO_2}=0,1.64=6,4\left(g\right)\)
\(n_{O_2}=\frac{V_{O_2}}{22,4}=\frac{3,36}{22,4}=0,15\left(mol\right)\)
\(=>m_{O_2}=n_{O_2}.M_{O_2}=0,15.32=4,8\left(g\right)\)
Đúng 0
Bình luận (1)
Đốt cháy hoàn toàn 2 8 gam hỗn hợp gồm C và S , thể tích khí O2 (đktc)cần dùng là 3,36 lít. Tính phần trăm khối lượng của C trong hỗn hợp .
số liệu phải là 2,8 g hh nhé
C+O2-to>CO2
x-----x
S+O2-to>SO2
y----y
Ta có :\(\left\{{}\begin{matrix}12x+32y=2,8\\x+y=0,15\end{matrix}\right.\)
=>x=0,1 mol, y=0,05 mol
=>%mC=\(\dfrac{0,1.12}{2,8}.100=42,86\%\)
=>%mS=100-42,86=57,14%
Đúng 2
Bình luận (1)
Gọi nC = a (mol); nS = b (mol)
12a + 32b = 2,8 (g) (1)
nO2 = 3,36/22,4 = 0,15 (mol)
PTHH:
C + O2 -> (t°) CO2
Mol: a ---> a
S + O2 -> (t°) SO2
Mol: b ---> b
a + b = 0,15 (mol) (2)
Từ (1), (2) => a = 0,1 (mol); b = 0,05 (mol)
mC = 0,1 . 12 = 1,2 (g)
%mC = 1,2/2,8 = 42,85%
Đúng 0
Bình luận (1)
Cho 10 gam hỗn hợp X gồm Fe, Fe 2 O 3 , S trong đó O chiếm 24% khối lượng. Hỗn hợp
X tác dụng vừa hết với dung dịch H 2 SO 4 dư sinh ra 1,68 lít khí SO 2 (ở đktc) và dung dịch Y.
Đốt cháy hoàn toàn 10 gam X bằng lượng vừa đủ V lít (đktc) hỗn hợp khí A gồm O 2 và O 3 tỷ lệ
mol 1 : 1. Giá trị của V là?
n O = 10.24%/16 = 0,15(mol)
Quy đổi X gồm n Fe = a(mol) ; n S = b(mol) ; n O = 0,15(mol)
=> 56a + 32b + 0,15.16 = 10(1)
n SO2 = 1,68/22,4 = 0,075(mol)
Bảo toàn electron :
3a + 6b = 0,15.2 + 0,075.2(2)
Từ (1)(2) suy ra a = 0,13 ; b = 0,01
Gọi n O2 = n O3 = x(mol)
Bảo toàn electron :
4n O2 + 6n O3 + 2n O = 3n Fe + 4n S
<=> 4x + 6x + 0,15.2 = 0,13.3 + 0,01.4
<=> x = 0,013
=> V = (0,013 + 0,013).22,4 = 0,5824 lít
Đúng 1
Bình luận (0)
Khối lượng hỗn hợp khí ở đktc gồm 11,2 lít N2 và 3,36 lít O2 là:
\(m_{N_2}=\left(\dfrac{11,2}{22,4}\right).28=14g\)
\(m_{O_2}=\left(\dfrac{3,36}{22,4}\right).32=4,8g\)
=> mhh = 14 + 4,8 = 18,8g
Đúng 0
Bình luận (0)
Hòa tan m gam Cu vào dung dịch axit HNO3 thu được dung dịch muối Cu(NO3)2 và 3,36 lít hỗn hợp X gồm khí NO và NO2 (ở đktc, không có sản phẩm phụ nào khác). Biết tỉ khối hơi của hỗn hợp X so với khí H2 là 19. Tính khối lượng kim loại m?
Đọc tiếp
Hòa tan m gam Cu vào dung dịch axit HNO3 thu được dung dịch muối Cu(NO3)2 và 3,36 lít hỗn hợp X gồm khí NO và NO2 (ở đktc, không có sản phẩm phụ nào khác). Biết tỉ khối hơi của hỗn hợp X so với khí H2 là 19. Tính khối lượng kim loại m?
Cho 10g hỗn hợp gồm Mg và Cu tác dụng với dd HCl dư, thoát ra 3,36 lít khí H2 ở đktc. Tính % khối lượng Mg và Cu trong hỗn hợp
\(Mg+2HCl \to MgCl_2+H_2\\ n_{H_2}=0,15(mol)\\ \to n_{Mg}=n_{H_2}=0,15(mol)\\ \%m_{Mg}=\frac{0,15.24}{10}.100\%=36\%\\ \%m_{Cu}=100\%-36\%=64\%\)
Đúng 4
Bình luận (0)