Hoà tan 9,875 g một muối hiđrocacbonat vào nước và cho tác dụng với dd H2SO4 vừa đủ thu được 8,25 g một muối sunfat trung hoà khan. Xác định công thức của muối hiđrocacbonat.

Những câu hỏi liên quan
Hoà tan 19,75 gam một muối hiđrocacbonat vào nước thu được dung dịch X. Cho X tác dụng với một lượng dung dịch H2SO4 10% vừa đủ, sau đó đem cô cạn dung dịch thì thu được 16,5 gam một muối sunfat trung hoà khan. Công thức phân tử của muối hiđrocacbonat là A. Ba(HCO3)2 B. NaHCO3 C. Mg(HCO3)2 D. NH4HCO3
Đọc tiếp
Hoà tan 19,75 gam một muối hiđrocacbonat vào nước thu được dung dịch X. Cho X tác dụng với một lượng dung dịch H2SO4 10% vừa đủ, sau đó đem cô cạn dung dịch thì thu được 16,5 gam một muối sunfat trung hoà khan. Công thức phân tử của muối hiđrocacbonat là
A. Ba(HCO3)2
B. NaHCO3
C. Mg(HCO3)2
D. NH4HCO3
Hòa tan 9,875 g một muối hiđrocacbonat ( muối A ) vào nước cho tác dụng với H2SO4 vừa đủ thu được muối sunfat trung hòa, khí cacbon điôxit và nước .Khi cô cạn dung dịch sau phản ứng thu được 8,25 gam muối sunfat trung hòa khan. Viết phương trình hóa học, xác định công thức của A và đọc tên muối A

Đọc tên:amoni bicacbonat
#Tham khảo
Cho 316,0 gam dung dịch một muối hiđrocacbonat (X) 6,25% vào dung dịch H2SO4 loãng vừa đủ, sau khi phản ứng xảy ra hoàn toàn thu được 16,5 gam muối sunfat trung hoà. Mặt khác cũng cho lượng dung dịch muối hiđrocacbonat (X) như trên vào dung dịch HNO3 vừa đủ, rồi cô cạn từ từ dung dịch sau phản ứng thì thu được 47,0 gam muối Y. Công thức của X, Y lần lượt là: A. NH4HCO3, NH4NO3.6H2O B. NaHCO3, NaNO3.3H2O C. NH4HCO3, NH4NO3.4H2O D. KHCO3, KNO3.4H2O
Đọc tiếp
Cho 316,0 gam dung dịch một muối hiđrocacbonat (X) 6,25% vào dung dịch H2SO4 loãng vừa đủ, sau khi phản ứng xảy ra hoàn toàn thu được 16,5 gam muối sunfat trung hoà. Mặt khác cũng cho lượng dung dịch muối hiđrocacbonat (X) như trên vào dung dịch HNO3 vừa đủ, rồi cô cạn từ từ dung dịch sau phản ứng thì thu được 47,0 gam muối Y. Công thức của X, Y lần lượt là:
A. NH4HCO3, NH4NO3.6H2O
B. NaHCO3, NaNO3.3H2O
C. NH4HCO3, NH4NO3.4H2O
D. KHCO3, KNO3.4H2O
Đáp án A
Nhận thấy các đáp án đều là muối X có dạng RHCO3
Ta có mMHCO3 = 0,0625×316= 19,75 gam
2RHCO3 + H2SO4 → R2SO4 + 2CO2 + 2H2O
19,75 gam ------------- 16,5 gam
Gọi số mol của RHCO3 là x mol → mRHCO3 - mR2SO4 =61x-48x= 3,25 → x = 0,25 → MMuối = 79 → MR = 18 (NH4). Loại B,D
Khi phản ứng với HNO3 thì nmuối = nRHCO3= 0,15 mol
→ Mmuối = 47 : 0,025= 188 (NH4NO3.6H2O)
Đúng 0
Bình luận (0)
hòa tan 9,875g một muối hidrocacbonat vào nước và cho tác dụng với một lượng H2SO4 vừa đủ thì thu được 8,25g một muối sunfat trung hòa khan. Tim công thức của muối
2R-HCO3 + H2SO4 -----> (R)2SO4 + 2CO2 + 2H2O
Từ 1 mol R -HCO3 ------> 1/2 mol (R)2SO4 thì khối lượng giảm: 61 - 96/2 = 13 gam
Vậy n R- HCO3 = ( 9,875 - 8,25 )/ 13 = 0,125 mol
M R-HCO3 = 79 => R = 18 => NH4+
X: NH4HCO3
Đúng 2
Bình luận (0)
Cho 5,53 gam một muối hiđrocacbonat A vào dung dịch H2SO4 loãng vừa đủ, sau khiphản ứng xảy ra hoàn toàn thu được 4,62 gam muối sunphat trung hoà. Cho 15,8 gam Avào dung dịch HNO3 vừa đủ, rồi cô cạn từ từ dung dịch sau phản ứng thì thu được 37,6gam muối B. Xác định công thức phân tử của B.2. Cho 3,6 gam oxit kim loại vào dung dịch H2SO4 đặc nóng thì thấy tạo ra 0,56 lít khíSO2 duy nhất (đo ở đktc) và 8,0 gam muối sunfat khan. Xác định công thức hóa học củaoxit. xin mọi người giúp đỡ nhanh chóng!...
Đọc tiếp
Cho 5,53 gam một muối hiđrocacbonat A vào dung dịch H2SO4 loãng vừa đủ, sau khi
phản ứng xảy ra hoàn toàn thu được 4,62 gam muối sunphat trung hoà. Cho 15,8 gam A
vào dung dịch HNO3 vừa đủ, rồi cô cạn từ từ dung dịch sau phản ứng thì thu được 37,6
gam muối B. Xác định công thức phân tử của B.
2. Cho 3,6 gam oxit kim loại vào dung dịch H2SO4 đặc nóng thì thấy tạo ra 0,56 lít khí
SO2 duy nhất (đo ở đktc) và 8,0 gam muối sunfat khan. Xác định công thức hóa học của
oxit.
xin mọi người giúp đỡ nhanh chóng!!!!!!
Cho 5,53 gam một muối hiđrocacbonat A vào dung dịch H2SO4 loãng vừa đủ, sau khiphản ứng xảy ra hoàn toàn thu được 4,62 gam muối sunphat trung hoà. Cho 15,8 gam Avào dung dịch HNO3 vừa đủ, rồi cô cạn từ từ dung dịch sau phản ứng thì thu được 37,6gam muối B. Xác định công thức phân tử của B.2. Cho 3,6 gam oxit kim loại vào dung dịch H2SO4 đặc nóng thì thấy tạo ra 0,56 lít khíSO2 duy nhất (đo ở đktc) và 8,0 gam muối sunfat khan. Xác định công thức hóa học củaoxit. xin mọi người giúp đỡ nhanh chóng!...
Đọc tiếp
Cho 5,53 gam một muối hiđrocacbonat A vào dung dịch H2SO4 loãng vừa đủ, sau khi
phản ứng xảy ra hoàn toàn thu được 4,62 gam muối sunphat trung hoà. Cho 15,8 gam A
vào dung dịch HNO3 vừa đủ, rồi cô cạn từ từ dung dịch sau phản ứng thì thu được 37,6
gam muối B. Xác định công thức phân tử của B.
2. Cho 3,6 gam oxit kim loại vào dung dịch H2SO4 đặc nóng thì thấy tạo ra 0,56 lít khí
SO2 duy nhất (đo ở đktc) và 8,0 gam muối sunfat khan. Xác định công thức hóa học của
oxit.
xin mọi người giúp đỡ nhanh chóng!!!!!!
Cho 9,125 gam muối hiđrocacbonat hóa trị II phản ứng hết với dung dịch H2SO4 dư thu được dung dịch chứa 7,5 gam muối sunfat trung hòa. Công thức của muối hiđrocacbonat là: A. Zn(HCO3)2 B. Mg(HCO3)2 C. Ba(HCO3)2 D. Ca(HCO3)2
Đọc tiếp
Cho 9,125 gam muối hiđrocacbonat hóa trị II phản ứng hết với dung dịch H2SO4 dư thu được dung dịch chứa 7,5 gam muối sunfat trung hòa. Công thức của muối hiđrocacbonat là:
A. Zn(HCO3)2
B. Mg(HCO3)2
C. Ba(HCO3)2
D. Ca(HCO3)2
Đáp án B
Đặt công thức muối hiđrocacbonat là R(HCO3)2
R(HCO3)2 +H2SO4 → RSO4+ 2CO2+ 2H2O
Theo PT ta thấy: n R ( H C O 3 ) 2 = n R S O 4
→ 9 , 125 R + 122 = 7 , 5 R + 96 → R = 24
→R là Mg→ Muối Mg(HCO3)2
Đúng 0
Bình luận (0)
Hòa tan 10,8 g Mg vào dd H2SO4 20 % vừa đủ , sau khi phản ứng kết thúc thu được dd X . Làm lạnh dd X xuống 20 độ C thu được 14,76 g muối sunfat kết tinh ngậm nước tách ra và còn lại dd muối bão hòa có nồng độ 21,703 % . Xác định CT muối sunfat ngậm nước .
\(n_{Mg}=\dfrac{10,8}{24}=0,45\left(mol\right)\)
PTHH: Mg + H2SO4 --> MgSO4 + H2
0,45-->0,45------>0,45--->0,45
=> \(m_{H_2SO_4}=0,45.98=44,1\left(g\right)\)
=> \(m_{ddH_2SO_4}=\dfrac{44,1.100}{20}=220,5\left(g\right)\)
mdd (20oC) = 10,8 + 220,5 - 0,45.2 - 14,76 = 215,64 (g)
\(m_{MgSO_4\left(dd.ở.20^oC\right)}=\dfrac{215,64.21,703}{100}=46,8\left(g\right)\)
=> nMgSO4 (tách ra) = \(0,45-\dfrac{46,8}{120}=0,06\left(mol\right)\)
=> nH2O (tách ra) = \(\dfrac{14,76-0,06.120}{18}=0,42\left(mol\right)\)
Xét nMgSO4 (tách ra) : nH2O (tách ra) = 0,06 : 0,42 = 1 : 7
=> CTHH: MgSO4.7H2O
Đúng 5
Bình luận (0)
Hoà tan 1,952 g muối
B
a
C
l
2
.
x
H
2
O
trong nước. Thêm
H
2
S
O
4
loãng, dư vào dung dịch thu được. Kết tủa tạo thành được làm khô và cân được 1,864 g. Xác định công thức hoá học của muối.
Đọc tiếp
Hoà tan 1,952 g muối B a C l 2 . x H 2 O trong nước. Thêm H 2 S O 4 loãng, dư vào dung dịch thu được. Kết tủa tạo thành được làm khô và cân được 1,864 g. Xác định công thức hoá học của muối.
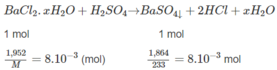
⇒ M = 244g/mol = M B a C l 2 . x H 2 O . Từ đó :
⇒ x = 2.
Đáp số : B a C l 2 . x H 2 O
Đúng 0
Bình luận (0)
hoà tan hoàn toàn 10,2g một oxit kim loại có hoá trị 3 vào 100g dung dụng h2so4 vừa đủ sau khi phản ứng xảy ra hoàn toàn thu được 34,2 g muối sunfat a)xác định tên kim loại b) tính nồng độ % của dung dịch h2so4 c) tính thể tích dung dịch NaOH 1,5 M cần dùng để kết tủa hoàn toàn dung dịch muối trên
\(Đặt.oxit:A_2O_3\\ A_2O_3+3H_2SO_4\rightarrow A_2\left(SO_4\right)_3+3H_2O\\ n_{Al_2O_3}=\dfrac{34,2-10,2}{96.3-16.3}=0,1\left(mol\right)\\ M_{A_2O_3}=\dfrac{10,2}{0,1}=102\left(\dfrac{g}{mol}\right)=2M_A+48\\ \Rightarrow M_A=27\left(\dfrac{g}{mol}\right)\\ a,\Rightarrow A.là.nhôm\left(Al=27\right)\\ b,n_{H_2SO_4}=3.0,1=0,3\left(mol\right)\\ C\%_{ddH_2SO_4}=\dfrac{0,3.98}{100}.100=29,4\%\\ c,n_{Al_2\left(SO_4\right)_3}=n_{Al_2O_3}=0,1\left(mol\right)\\ Al_2\left(SO_4\right)_3+6NaOH\rightarrow2Al\left(OH\right)_3+3Na_2SO_4\\ n_{NaOH}=6.0,1=0,6\left(mol\right)\\ V_{ddNaOH}=\dfrac{0,6}{1,5}=0,4\left(l\right)\)
Đúng 3
Bình luận (0)















