Cho 4,65 gam hỗn hợp A gồm M g X 2 và M g Y 2 (X, Y là 2 nguyên tố halogen ở 2 chu kỳ kế tiếp, M X < M Y ) phản ứng hoàn toàn với dd A g N O 3 dư, thu được 11,05 gam kết tủa. Xác định hai nguyên tố X, Y và tính khối lượng mỗi muối trong hỗn hợp A?

Những câu hỏi liên quan
Cho 6,56 gam hỗn hợp A gồm NaX và NaY (X, Y là 2 nguyên tố halogen ở 2 chu kỳ kế tiếp, M X < M Y ) phản ứng hoàn toàn và vừa đủ với 50 ml dd A g N O 3 1 M, thu được kết tủa. Xác định hai nguyên tố X, Y.
Cho 1,395 gam hỗn hợp A gồm M g X 2 và M g Y 2 (X, Y là 2 nguyên tố halogen ở 2 chu kỳ kế tiếp, M X < M Y ) phản ứng hoàn toàn với dd A g N O 3 dư, thu được 3,315 gam kết tủa. Xác định hai nguyên tố X, Y.
X,Y là hai nguyên tố halogen thuộc 2 chu kì liên tiếp. Hỗn hợp A chứa muối NaX và NaY, để kết tủa hoàn toàn 2,2 gam hỗn hợp A phải dùng 150ml dung dịch AgNO3 0,2M. Xác định 2 nguyên tố X và Y.
Quy NaX và NaY về NaR
\(n_{AgNO_3}=0,15.0,2=0,05\left(mol\right)\)
PTHH: \(AgNO_3+NaR\rightarrow AgR\downarrow+NaNO_3\)
0,05------>0,05
\(\rightarrow M_R=\dfrac{2,2}{0,05}=44\left(g\text{/}mol\right)\)
Mà X và Y là 2 nguyên tố halogen thuộc 2 chu kì liên tiếp
\(\rightarrow M_X< M_R< M_Y\rightarrow M_X< 44< M_Y\)
---> X và Y là Cl và Br
Đúng 3
Bình luận (1)
Cho 31,84 gam hỗn hợp NaX và NaY (X, Y là 2 nguyên tố halogen ở 2 chu kì liên tiếp) vào dung dịch AgNO3 dư thì thu được 57,34g kết tủa. Công thức của hai muối là A. NaBr và NaI B. NaF và NaCl. C. NaCl và NaBr D. NaF, NaCl hoặc NaBr, NaI
Đọc tiếp
Cho 31,84 gam hỗn hợp NaX và NaY (X, Y là 2 nguyên tố halogen ở 2 chu kì liên tiếp) vào dung dịch AgNO3 dư thì thu được 57,34g kết tủa. Công thức của hai muối là
A. NaBr và NaI
B. NaF và NaCl.
C. NaCl và NaBr
D. NaF, NaCl hoặc NaBr, NaI
TH1: NaF và NaCl
Kết tủa chỉ có AgCl
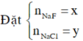
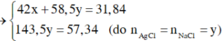
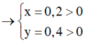
Vậy CT 2 muối có thể là NaF và NaCl
TH2: Hỗn hợp muối không chứa NaF
Đặt CT chung của 2 muối ban đầu là NaX
![]()
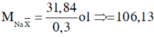
=> 2 muối là NaBr và NaI
Đáp án A
Đúng 0
Bình luận (0)
X, Y là hai nguyên tố halogen thuộc hai chu kì liên tiếp trong bảng tuần hoàn. Hỗn hợp A chứa 2 muối X, Y với natri. Để kết tủa hoàn toàn 2,2 gam hỗn hợp A phải dùng 150 ml dung dịch AgNO 3 0,2M. Xác định hai nguyên tố X và Y.
NaX + AgNO 3 → NaNO 3 + AgX
a mol a mol a mol a mol
NaY + AgNO 3 → NaNO 3 + AgY
b mol b moi b mol b mol
n AgNO 3 = 0,2 x 150/1000 = 0,O3 mol
m AgNO 3 = 0,3 x 170 = 5,1g
n NaNO 3 = 0,O3 => m NaNO 3 = 0,03 x 85 = 2,55g
Áp dụng định luật bảo toàn khối lượng, ta có :
2,2 + 5,1 = 2,55 + m kết tủa → m kết tủa = 4,75 (gam)
(108 + X)a + (108 + Y)b = 4,75 ; a + b = 0,O3 (mol)
Xa + Yb + 15,1. Cho X > Y ; Xa + Xb > Xa + Yb > Ya + Yb
X > 1,51/0,03 > Y > X > 50,3 > Y
X và Y là các halogen liên tiếp, vậy đó là brom (80) và Cl (35,5).
Đúng 0
Bình luận (0)
Cho 3,184g hỗn hợp NaX và NaY (X, Y là 2 nguyên tố halogen ở 2 chu kì liên tiếp; X, Y khác F) vào dung dịch A g N O 3 dư thì thu được 5,734g kết tủa. Công thức của 2 muối là
A. NaBr và NaI.
B. NaCl và NaI.
C. NaCl và NaBr.
D. Không xác định được.
Cho 31,84 gam hỗn hợp NaX và NaY (X, Y là 2 nguyên tố halogen ở 2 chu kì liên tiếp) vào dung dịch AgNO3 dư thì thu được 57,34g kết tủa.Biết cả NaX và NaY đều tạo kết tủa với AgNO3. Công thức của hai muối là A. NaBr và NaI B. NaF và NaCl C. NaCl và NaBr D. NaF, NaBr
Đọc tiếp
Cho 31,84 gam hỗn hợp NaX và NaY (X, Y là 2 nguyên tố halogen ở 2 chu kì liên tiếp) vào dung dịch AgNO3 dư thì thu được 57,34g kết tủa.Biết cả NaX và NaY đều tạo kết tủa với AgNO3. Công thức của hai muối là
A. NaBr và NaI
B. NaF và NaCl
C. NaCl và NaBr
D. NaF, NaBr
Đáp án A.
Hỗn hợp (NaX, NaY) = NaM
NaM + AgNO3 → AgM↓+NaNO3
Ta có
![]() => M = 81,6 => X,Y lần lượt là Br (80) và I (127)
=> M = 81,6 => X,Y lần lượt là Br (80) và I (127)
Đúng 0
Bình luận (0)
Cho 26,45 g hỗn hợp NaX và NaY ( X,Y là w halogen ở 2 chu kỳ liên tiếp ) vào dung dịch AgNO3 dư , thu được 51,95g hỗn hợp kết tủa a, tìm công thức của NaX và NaY b, tìm số mol mỗi muối trong hỗn hợp ban đầu
a)
Giả sử cả 2 chất đều cho kết tủa
\(NaM+AgNO_3\rightarrow AgM+NaNO_3\)
\(n_{NaM}=n_{AgM}\)
\(\Leftrightarrow\frac{26,45}{23+M}=\frac{51,95}{108+M}\)
\(\Rightarrow M=65,167\left(\frac{g}{mol}\right)\)
\(\Rightarrow\left\{{}\begin{matrix}NaX:NaCl\\NaY:NaBr\end{matrix}\right.\)
b, Gọi số mol của NaCl là a, số mol của NaBr là b
\(\left\{{}\begin{matrix}58,5a+103b=26,45\\143,5a+188b=51,95\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a=0,1\left(mol\right)\\b=0,2\left(mol\right)\end{matrix}\right.\)
Hỗn hợp khí X gồm oxi và clo có tỉ khối đối với hidro là 23,8 . Để phản ứng hết với 7,8 gam hỗn hợp Y gồm Mg và Al cần vừa hết 5,6 lít khí X ( đktc ) . Mặt khác 7,8 gam Y cũng phản ứng vừa hết với hỗn hợp Z gồm 2 halogen ở hai chu kì liên tiếp trong bảng tuần , thu được 54 gam muối .
a . Tính khối lượng mỗi kim loại có trong Y.
b . Xác định hai halogen và tính tỉ khối hơi của Z so với hidro . giúp em giải bài này vs ạ
Đọc tiếp
Hỗn hợp khí X gồm oxi và clo có tỉ khối đối với hidro là 23,8 . Để phản ứng hết với 7,8 gam hỗn hợp Y gồm Mg và Al cần vừa hết 5,6 lít khí X ( đktc ) . Mặt khác 7,8 gam Y cũng phản ứng vừa hết với hỗn hợp Z gồm 2 halogen ở hai chu kì liên tiếp trong bảng tuần , thu được 54 gam muối . a . Tính khối lượng mỗi kim loại có trong Y. b . Xác định hai halogen và tính tỉ khối hơi của Z so với hidro . giúp em giải bài này vs ạ
a)
Gọi số mol O2, Cl2 là a, b (mol)
=> \(\left\{{}\begin{matrix}a+b=\dfrac{5,6}{22,4}=0,25\\\overline{M}=\dfrac{32a+71b}{a+b}=23,8.2=47,6\end{matrix}\right.\)
=> a = 0,15; b = 0,1
Gọi số mol Mg, Al là x, y (mol)
=> 24x + 27y = 7,8 (1)
Mg0 - 2e --> Mg+2
x---->2x
Al0 - 3e --> Al+3
y--->3y
O20 + 4e --> 2O-2
0,15->0,6
Cl20 + 2e --> 2Cl-
0,1-->0,2
Bảo toàn e: 2x + 3y = 0,8 (2)
(1)(2) => x = 0,1; y = 0,2
=> \(\left\{{}\begin{matrix}m_{Mg}=0,1.24=2,4\left(g\right)\\m_{Al}=0,2.27=5,4\left(g\right)\end{matrix}\right.\)
b) Gọi công thức chung của 2 halogen là \(\overline{T_2}\)
\(m_{\overline{T_2}}=54-7,8=46,2\left(g\right)\)
Mg0 - 2e --> Mg+2
0,1---->0,2
Al0 - 3e --> Al+3
0,2-->0,6
\(\overline{T_2}+2e\rightarrow2\overline{T}^-\)
Bảo toàn e: \(n_{\overline{T_2}}=0,4\left(mol\right)\)
=> \(M_{\overline{T_2}}=\dfrac{46,2}{0,4}=115,5\left(g/mol\right)\)
Mà 2 halogen ở 2 chu kì liên tiếp
=> 2 halogen là Cl2, Br2
\(\overline{M}_Z=115,5\left(g/mol\right)\)
=> \(d_{Z/H_2}=\dfrac{115,5}{2}=57,75\)
Đúng 2
Bình luận (0)













