Tính nguyên tử khối của clo và axit cacbonic (Cho H=1,O=16,C=12

Những câu hỏi liên quan
Tính phân tử khối của clo và Axit cacbonic cho H=1,O=16,C=12
\(PTK_{H_2CO_3}=1.2+12+16.3=62\left(đvC\right)\)
\(PTK_{Cl_2}=35,5.2=71\left(đvC\right)\)
Đúng 2
Bình luận (0)
Tính nguyên tử khối của clo và axit cacbonic Cho H=2,O=3,C=1
\(NTK_{Cl}=35,5\left(đvC\right)\)
\(PTK_{H_2CO_3}=1.2+12+16.3=62\left(đvC\right)\)
Đúng 1
Bình luận (2)
Nêu công thức hóa học và tính nguyên tử khối của Axit cacbonic (2H,1C,3O) Cho H=1,C=12,O=16
. Phân tử 1 hợp chất gồm nguyên tử nguyên tố X liên kết với 4 nguyên tử H và nặng bằng nguyên tử O. (Cho O =16,C=12 ; H =1)
a/ Tính phân tử khối của hợp chất.
b/ Tính nguyên tử khối, cho biết tên và kí hiệu hóa học của nguyên tố X.
c/ Lập công thức hóa học của hợp chất.
\(a,PTK_{HC}=NTK_{O}=16(đvC)\\ b,PTK_{HC}=NTK_{X}+4NTK_{H}=16(đvC)\\ \Rightarrow NTK_{X}=16-4=12(đvC)\\ \text {Vậy x là Cacbon (C)}\\ c,CTHH_{HC}:CH_4\)
Đúng 2
Bình luận (0)
Trong tự nhiên Clo có 2 đồng vị
C
35
l
và
C
37
l
.
Nguyên tử khối trung bình của Clo là 35,5. Phần trăm về khối lượng của
C
35
l
trong HClO là (cho nguyên tử khối của H và O lần lượt là 1 và 16) A. 50,00%. B. 48,67%. C. 51,23%. D. 55,20%.
Đọc tiếp
Trong tự nhiên Clo có 2 đồng vị C 35 l và C 37 l . Nguyên tử khối trung bình của Clo là 35,5. Phần trăm về khối lượng của C 35 l trong HClO là (cho nguyên tử khối của H và O lần lượt là 1 và 16)
A. 50,00%.
B. 48,67%.
C. 51,23%.
D. 55,20%.
Bài 5. Clo có hai đồng vị là 3537 1717;ClCl . Tỉ lệ % số nguyên tử của hai đồng vị là 3 : 1. a. Tính NTKTB của Clo? b. Tính thành phần % khối lượng của 35 Cl trong HClO 4 ? (H =1, O = 16). c. Tính số nguyên tử của 37 Cl trong 200 ml dung dịch MgCl 2 2M (Mg =24)? d. Tính số nguyên tử của 35 Cl trong 4,48 lít khí HCl (đkc)? (H = 1)
Cho
N
A
6
,
02.10
23
m
o
l
.
C
12
,
O
16.
Số nguyên tử oxi và số nguyên tử cacbon trong 1 gam khí cacbonic là A.
137.10
20
và
472
.10
20
B.
137.10
20...
Đọc tiếp
Cho N A = 6 , 02.10 23 m o l . C = 12 , O = 16. Số nguyên tử oxi và số nguyên tử cacbon trong 1 gam khí cacbonic là
A. 137.10 20 và 472 .10 20
B. 137.10 20 và 274.10 2
C. 137.10 20 và 274.10 20
D. 274.10 20 và 137.10 20
Trong tự nhiên clo là hỗn hợp 2 đồng vị 35Cl và 37Cl. Cho H 1, O 16, nguyên tử khối trung bình của clo là 35,5. Thành phần % về khối lượng 37Cl có trong HClO4 là A. 9,20%. B. 25,00%. C. 35,32%. D. 75,00%.
Đọc tiếp
Trong tự nhiên clo là hỗn hợp 2 đồng vị 35Cl và 37Cl. Cho H = 1, O = 16, nguyên tử khối trung bình của clo là 35,5. Thành phần % về khối lượng 37Cl có trong HClO4 là
A. 9,20%.
B. 25,00%.
C. 35,32%.
D. 75,00%.
Đáp án A
Giả sử % nguyên tử 35Cl và 37Cl trong tự nhiên lần lượt là x, y.
Ta có hpt
x + y = 1 35 x + 37 y = 35 , 5
⇒ x = 0 , 75 y = 0 , 25
Phần trăm khối lượng của 37Cl trong HClO4 là
(0,24.37)/ (1+35,5+ 16.4) = 9,2 %
Đúng 0
Bình luận (0)
Nguyên tử khối trung bình của Clo là 35,5. Clo trong tự nhiên có hai đồng vị là 35 Cl và 37 Cl. Tính phần trăm về khối lượng của 37 Cl chứa trong HClO4 (với Hidro đồng vị là 1 H, oxi đồng vị là 16 O)
\(\%^{35}Cl=x\%\Rightarrow\%^{37}Cl=\left(100-x\right)\%\)
\(\overline{M}=\dfrac{35x+37\cdot\left(100\%-x\right)}{100\%}=35.5\left(g\text{/}mol\right)\)
\(\Rightarrow x=75\%\)
\(\%^{37}Cl_{\left(HClO_4\right)}=\dfrac{25\%\cdot37}{1+35.5+16\cdot4}\cdot100\%=9.2\%\)
Đúng 3
Bình luận (1)
Phần trăm đồng vị 35Cl = x, thì % đồng vị 37Cl = 100 - x
Ta có:
, vậy x = 75%.
Phần trăm khối lượng của 37Cl trong HClO4=
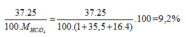
Đúng 1
Bình luận (2)

















