hòa tan 0,23 gam Na vào H2O dư thu được dung dịch X.Tính pH của dd X

Những câu hỏi liên quan
Hòa tan hoàn toàn 4,6 gam Na vào 120,6 gam nước thu được dung dịch X.
Tính C% chất tan trong dung dịch sau phản ứng.
$n_{Na} = \dfrac{4,6}{23} = 0,2(mol)$
$2Na + 2H_2O \to 2NaOH + H_2$
$n_{H_2} = \dfrac{1}{2}n_{Na} = 0,1(mol)$
$n_{NaOH} = n_{Na} = 0,2(mol)$
Sau phản ứng :
$m_{dd} = 4,6 + 120,6 - 0,1.2 = 125(gam)$
$C\%_{NaOH} = \dfrac{0,2.40}{125}.100\% =6,4\%$
Đúng 3
Bình luận (3)
2Na+ 2H2O→ 2NaOH+ H2
(mol) 0,2 0,2 0,2 0,1 nNa=\(\dfrac{m}{M}=\dfrac{4,6}{23}=0,2\)(mol)
\(n_{H_2O}=\dfrac{m}{M}=\dfrac{120,6}{18}=6,7\)(mol)
Xét tỉ lệ:
Na H2O
\(\dfrac{0,2}{2}\) < \(\dfrac{6,7}{2}\)
=> Na phản ứng hết, nước dư
\(m_{H_2}\)=n.M=0,1.2=0,2(g)
mdd sau phản ứng = mNa+ \(m_{H_2O}\)-\(m_{H_2}\)
= 4,6 +120,6 -0,2= 125(g)
mNaOH=n.M= 0,2.40=8(g)
C%NaOH=\(\dfrac{8}{125}.100\%=0,064\%\)
Đúng 0
Bình luận (1)
Số mol của natri
nNa= \(\dfrac{m_{Na}}{M_{Na}}=\dfrac{4,6}{23}=0,2\left(mol\right)\)
Pt : 2Na + 2H2O → 2NaOH + H2
2 2 2 1
0,2 0,2
Số mol của natri hidroxit
nNaOH = \(\dfrac{0,2.2}{2}=0,2\left(mol\right)\)
Khối lượng của natri hidroxit
mNaOH = nNaOH . MNaOH
= 0,2. 40
= 8 (g)
Nồng độ phần trăm của natri hidroxit
C0/0NaOH= \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{8.100}{4,6+120,6}=6,4\)0/0
Chúc bạn học tốt
Đúng 2
Bình luận (0)
1,Hòa tan 0,69(g) Na vào nước để được 300ml dung dịch X.Tính pH của dung dich X
Ta có: \(n_{Na}=\dfrac{0,69}{23}=0,03\left(mol\right)=n_{NaOH}=n_{OH^-}\)
\(\Rightarrow\left[OH^-\right]=\dfrac{0,03}{0,3}=0,1\left(M\right)\) \(\Rightarrow pH=14+log\left[OH^-\right]=13\)
Đúng 1
Bình luận (0)
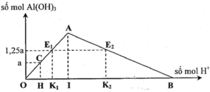
Hòa tan hòan toàn m gam hỗn hợp Na và Al (tỉ lệ mol 1:1) vào H2O dư thu được dung dịch X. Cho từ từ 200 ml dung dịch HCl 1M vào X thì thu được t gam kết tủa. Nếu cho từ từ 300ml dung dịch HCl 1M vào dung dịch X thì thu được 1,25t gam kết tủa. Giá trị của m là A. 12,6 B. 13,125 C. 18,75 D. 9,25
Đọc tiếp
Hòa tan hòan toàn m gam hỗn hợp Na và Al (tỉ lệ mol 1:1) vào H2O dư thu được dung dịch X. Cho từ từ 200 ml dung dịch HCl 1M vào X thì thu được t gam kết tủa. Nếu cho từ từ 300ml dung dịch HCl 1M vào dung dịch X thì thu được 1,25t gam kết tủa. Giá trị của m là
A. 12,6
B. 13,125
C. 18,75
D. 9,25
Chọn đáp án B
Nhận xét nhanh
+ Vì hỗn hợp Na và Al (tỉ lệ mol 1:1) nên dung dịch X chỉ có NaAlO2.
+ Vì lượng HCl tăng 1,5 lần mà lượng kết tủa tăng chưa đến 1,5 lần.Nên lần 1 kết tủa chưa cực đại và lần 2 kết tủa đã bị tan 1 phần.
Ta có
![]()
![]()
Với thí nghiệm 2
![]()
![]()
![]()
![]()
Đúng 0
Bình luận (0)
Hòa tan hết một lượng hỗn hợp gồm K và Na vào H2O dư, thu được dung dịch X và 0,672 lít khí H2 (đktc). Cho X vào dung dịch FeCl3 dư, đến khi phản ứng xảy ra hoàn toàn, thu được m gam kết tủa . Giá trị của m là: A. 2,14. B. 6,42. C. 1,07 D. 3,21.
Đọc tiếp
Hòa tan hết một lượng hỗn hợp gồm K và Na vào H2O dư, thu được dung dịch X và 0,672 lít khí H2 (đktc). Cho X vào dung dịch FeCl3 dư, đến khi phản ứng xảy ra hoàn toàn, thu được m gam kết tủa . Giá trị của m là:
A. 2,14.
B. 6,42.
C. 1,07
D. 3,21.
Đáp án A
nOH- = 2nH2 = 0,06mol
=> nFe(OH)3 = 0,02mol
=> m = 2,14g
Đúng 0
Bình luận (0)
Hòa tan hết một lượng hỗn hợp gồm K và Na vào H2O dư, thu được dung dịch X và 0,672 lít khí H2 (đktc). Cho X vào dung dịch FeCl3 dư, đến khi phản ứng xảy ra hoàn toàn, thu được m gam kết tủa . Giá trị của m là: A. 2,14 B. 6,42 C. 1,07 D. 3,21
Đọc tiếp
Hòa tan hết một lượng hỗn hợp gồm K và Na vào H2O dư, thu được dung dịch X và 0,672 lít khí H2 (đktc). Cho X vào dung dịch FeCl3 dư, đến khi phản ứng xảy ra hoàn toàn, thu được m gam kết tủa . Giá trị của m là:
A. 2,14
B. 6,42
C. 1,07
D. 3,21
Đáp án A
nOH- = 2nH2 = 0,06mol
=> nFe(OH)3 = 0,02mol
=> m = 2,14g
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn m gam hỗn hợp Na và Al (tỉ lệ mol 1:1) vào H2O dư thu được dung dịch X. Cho từ từ 200 ml dung dịch HCl 1M vào X thì thu được t gam kết tủa. Nếu cho từ từ 300 ml dung dịch HCl 1M vào dung dịch X thì thu được 1,25t gam kết tủa. Giá trị của m là A. 12,6 B. 13,125 C. 18,75 D. 9,25
Đọc tiếp
Hòa tan hoàn toàn m gam hỗn hợp Na và Al (tỉ lệ mol 1:1) vào H2O dư thu được dung dịch X. Cho từ từ 200 ml dung dịch HCl 1M vào X thì thu được t gam kết tủa. Nếu cho từ từ 300 ml dung dịch HCl 1M vào dung dịch X thì thu được 1,25t gam kết tủa. Giá trị của m là
A. 12,6
B. 13,125
C. 18,75
D. 9,25
Hòa tan m gam kim loại Na vào trong H2O thu được dung dịch X. Trung hòa dung dịch X cần 100 ml dung dịch H2SO4 1M. Giá trị của m là:
A. 2,3
B. 9,2
C. 4,6
D. 6,9
Đáp án C
Các phản ứng: Na + H2O → NaOH + ½ H2
2NaOH + H2SO4 → Na2SO4 + 2H2O
nH2SO4 = 0,1.1 = 0,1 mol
Theo các phản ứng: nNa = nNaOH = 2nH2SO4 = 0,2 mol
=> mNa = m = 23.0,2 = 4,6g
Đúng 0
Bình luận (0)
Hoà tan 1,17 gam nacl vào 2,08 gam BaCl2 vào nước thu được 100ml dd X.Tính nồng độ mol các ion trong dung dịch X
\(n_{NaCl}=\dfrac{1,17}{58,5}=0,02\left(mol\right)\\ n_{BaCl_2}=\dfrac{2,08}{208}=0,01\left(mol\right)\\ \left[Na^+\right]=\dfrac{0,02}{0,1}=0,2\left(M\right)\\ \left[Ba^{2+}\right]=\dfrac{0,01}{0,1}=0,1\left(M\right)\\ \left[Cl^-\right]=\dfrac{0,02+0,01.2}{0,1}=0,4\left(M\right)\)
Đúng 2
Bình luận (0)
Hòa tan m gam hỗn hợp X gồm Na và Al vào nước dư, thu được 8,96 lít khí. Cũng hòa tan hoàn toàn m gam hỗn hợp X gồm Na và Al vào dung dịch NaOH dư, thu được 12,32 lít khí (đktc). Giá trị của m là A. 21,10 B. 11,90 C. 22,45 D. 12,70
Đọc tiếp
Hòa tan m gam hỗn hợp X gồm Na và Al vào nước dư, thu được 8,96 lít khí. Cũng hòa tan hoàn toàn m gam hỗn hợp X gồm Na và Al vào dung dịch NaOH dư, thu được 12,32 lít khí (đktc). Giá trị của m là
A. 21,10
B. 11,90
C. 22,45
D. 12,70
Đáp án D
Do VH2 thu được ở 2 thí nghiệm khác nhau
⇒ Al dư ở thí nghiệm 1.
Đặt nNa = x; nAl = y.
● Xét thí nghiệm 1: Na → NaOH → NaAlO2.
⇒ nAl phản ứng = nNa = x.
Bảo toàn electron:
x + 3x = 2 × 0,4 ⇒ x = 0,2 mol.
● Xét thí nghiệm 2: Do NaOH dư
⇒ Al tan hết. Bảo toàn electron:
x + 3y = 2 × 0,55 ⇒ y = 0,3 mol.
||► m = 0,2 × 23 + 0,3 × 27 = 12,7(g).
Đúng 0
Bình luận (0)