FeO + 2H+ -> Fe2++ H2O
Viết phương trình phân tử
Viết phương trình phân tử từ phương trình rút gọn : FeO + 2H+ -> Fe2++ H2O
Viết phương trình phân tử của
FeO + 2H+-> Fe2+ +H2O
a. Na + O2 - - -- > Na2O
b. KClO3 - - - - > KCl + O2 ↑
c. FeO + HCl - - -- > FeCl2 + H2O
d. Fe2O3 + H2SO4 - - -- > Fe2(SO4)3 + H2O
e. P + O2 - - -- > P2O5
Hãy viết thành phương trình hóa học và cho biết tỉ lệ số nguyên tử, số phân tử của các chất trong mỗi phương trình hóa học lập được
\(a.4Na+O_2-^{t^o}\rightarrow2Na_2O\left(4:1:2\right)\\ b.2KClO_3-^{t^o}\rightarrow2KCl+3O_2\left(2:2:3\right)\\ c.FeO+2HCl\rightarrow FeCl_2+H_2\left(1:2:1:1\right)\\ d.Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_2+3H_2O\left(1:3:1:3\right)\\ e.4P+5O_2-^{t^o}\rightarrow2P_2O_5\left(4:5:2\right)\)
Cân bằng các phương trình hóa học bằng hệ số chữ:
1.Fe + HNO3→ Fe(NO3)3 + NO + H2O
2.FeO + HNO3 → Fe(NO3)3 + NO + H2O 3
.FeO + H2SO4 → Fe2(SO4)3 + SO2 + H2O
\(1.Fe + 4HNO_3→ Fe(NO_3)_3 + NO +2 H_2O\)
\(Fe\rightarrow Fe^{3+}+3e|.1\\ N^{+5}+3e\rightarrow N^{+2}|.1\)
\(2.3FeO + 10HNO_3 → 3Fe(NO_3)_3 + NO +5 H_2O \)
\(Fe^{+2}\rightarrow Fe^{3+}+1e|.3\\ N^{+5}+3e\rightarrow N^{+2}|.1\)
\(3.2FeO +4 H_2SO_4 → Fe_2(SO_4)_3 + SO_2 + 4H_2O\)
\(2Fe^{+2}\rightarrow Fe_2^{3+}+2e|.1\\ S^{+6}+2e\rightarrow S^{+4}|.1\)
Cho sơ đồ phản ứng:
H2SO4 (đặc, nóng) + Fe -> Fe2(SO4)3 + H2O + SO2.
Số phân tử H2SO4 bị khử và số phân tử H2SO4 trong phương trình hóa học của phản ứng trên là:
A. 3 và 6
B. 3 và 3
C. 6 và 3
D. 6 và 6
Chọn B
2Fe + 6H2SO4 -> Fe2(SO4)3 + 3SO2 + 6H2O
Số phân tử bị khử thành SO2 chính bằng số SO2
Cho phản ứng: F e O + H N O 3 → F e N O 3 + N O + H 2 O .
Trong phương trình của phản ứng trên có bao nhiêu phân tử đóng vai trò là chất oxi hóa:
A. 4
B. 8
C. 10
D. 1
Cho sơ đồ phản ứng: H2SO4 (đặc nóng) + Fe ® Fe2(SO4)3 + SO2 +H2O
Số phân tử H2SO4 bị khử trong phương trình hoá học của phản ứng trên là
A. 2.
B. 4.
C. 6.
D. 3.
Đáp án D
Số oxi hoá các nguyên tố thay đổi:
Fe 0 + H 2 S + 6 O 4 ( đặc ) → t ° Fe 2 + 3 ( SO 4 ) 3 + S + 4 O 2 + H 2 O
Số phân tử H2SO4 bị khử chính là số phân tử H2SO4 là chất oxi hoá. H2SO4 là chất oxi hoá khi S + 6 chuyển thành S + 4
Các quá trình nhường, nhận electron:
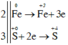
=> Số phân tử H2SO4 bị khử là 3
Cho các phương trình ion rút gọn sau:
(1) 3Cu + 8H+ + 2 N O 3 - → 3Cu2+ + 2NO + 4H2O
(2) Cu + 2H+ + O2→ Cu2+ + H2O
(3) 6Cl- + C r 2 O 7 2 - + 14H+→ 2Cr3+ + 3Cl2 + 7H2O
(4) Fe + 2H+→ Fe2+ + H2
(5) 5Fe2+ + M n O 4 - + 8H+→ 5Fe3+ + Mn2+ + 4H2O
(6) MnO2 + 4H+ + 2Cl-→ Mn2+ + Cl2 + 2H2O
Số phương trình mà trong đó H+ đóng vai trò là chất môi trường là.
A. 5
B. 3
C. 4
D. 2
Để ý H+ đóng vai trò là môi trường nếu trước và sau nó đều là H+, không bị oxi hóa thành H2
=>Có phản ứng 1, 2, 3, 5, 6
=>Đáp án A
Viết 2 PTHH dạng phân tử cho mỗi PTHH dạng ion rút gọn sau
FeS + 2H+ → Fe2+ + H2S
\(FeS+2HCl\rightarrow H_2S+FeCl_2\)
\(FeS+2HNO_3\rightarrow Fe\left(NO_3\right)_2+H_2S\)