cho m(g) Al vào 54,75(g) dung dịch HCL 20% đến khi phản ứng xong thu được dung dịch AlCl3 và V(l) khí H2 đo đktc . Viết PTHH và tính m , V

Những câu hỏi liên quan
cho m(g) Fe tan hết trong 500ml dung dịch HCL 0,2M đến khi phản ứng xong thu được dung dịch muối FeCl2 và V(l) khí H2 (đktc) .viết PTHH tính m,V
$n_{HCl}=0,2.0,5=0,1mol$
$PTHH :$
$Fe+2HCl\to FeCl_2+H_2$
$Theo\ pt :$
$n_{Fe}=n_{H_2}=\dfrac{1}{2}.n_{HCl}=\dfrac{1}{2}.0,1=0,05mol$
\(\Rightarrow\)$m=m_{Fe}=0,05.56=2,8g$
$V=V_{H_2}=0,05.22,4=1,12l$
Đúng 0
Bình luận (0)
: Hòa tan hoàn toàn 8,1 g Nhôm (Al) vào dung dịch axit clohiđric có chứa m (g) HCl, sau phản ứng thu được khí hiđro H2 và dung dịch muối Nhôm clorua (AlCl3)
a. Viết PTHH.
b. Tính thể tích khí H2 thu được (ở đktc).
c. Tính m.
d. Tính khối lượng muối AlCl3 tạo thành sau phản ứng (bằng 2 cách
ai giúp mik vs cảm ơn trước:]
2Al+6HCl-->2AlCl3+3H2
0,3----0,9---------0,3------0,45
=>n Al=8,1\17=0,3 mol
=>VH2=0,45.22,4=10,08l
=>m HCl=0,9.26,5=32,85g
=>mAlCl3=0,3.133,5=40,05g
C2 :Bảo Toàn khối lượng
=>m AlCl3=40,05g
Đúng 2
Bình luận (0)
Câu 11: Hòa tan hoàn toàn 8,1 g Nhôm (Al) vào dung dịch axit clohiđric có chứa m (g) HCl, sau phản ứng thu được khí hiđro H2 và dung dịch muối Nhôm clorua (AlCl3)
a. Viết PTHH.
b. Tính thể tích khí H2 thu được (ở đktc).
c. Tính m.
d. Tính khối lượng muối AlCl3 tạo thành sau phản ứng (bằng 2 cách)
a. 2Al + 6HCl -> 2AlCl3 + 3H2
b. nAl = \(\dfrac{8.1}{27}=0,3\left(mol\right)\)=> \(n_{H_2}=\dfrac{3}{2}.0,3=0,45\left(mol\right)\)
\(V_{H_2}=0,45.22,4=10,08\left(mol\right)\)
Đúng 0
Bình luận (0)
c. \(n_{HCl}=3n_{Al}=3.0,3=0,9\left(mol\right)=>m_{HCl}=0,9.36,5=32,85\left(g\right)\)
Vậy m = 32,85
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Cho 5,4 g nhôm(Al)tác dụng với 18,25 g dung dịch axit clohiđric (HCL) thu được AlCl3 và khí H2 thoát ra. a)hãy viết phương trình phản ứng xảy ra b) tính thể tích khí H2 thu được ở (đktc) c)tính khối lượng AlCl3 thu được
\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
PTHH:
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
0,2 0,2 0,3
\(V_{H_2}=n.22,4=6,72\left(l\right)\)
\(m_{AlCl_3}=n.M=0,2.133,5=26,7\left(g\right)\)
Đúng 2
Bình luận (0)
a) \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
b) \(n_{Al}=\dfrac{m}{M}=\dfrac{5,4}{27}=0,2\left(mol\right)\) ; \(n_{HCl}=\dfrac{m}{M}=\dfrac{18,25}{36,5}=0,5\left(mol\right)\)
\(2Al\) \(+\) \(6HCl\) → \(2AlCl_3\) \(+\) \(3H_2\)
Tỉ lệ: \(\dfrac{0,2}{2}>\dfrac{0,5}{6}\) ⇒ Al dư, tính theo HCl
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(0,5\) → \(\dfrac{1}{6}\) → \(0,25\) ( mol )
\(V_{H_2}=n.22,4=0,25.22,4=5,6\left(l\right)\)
c) \(m_{AlCl_3}=n.M=\dfrac{1}{6}.\left(27+35,5.3\right)=22,25\left(g\right)\)
Đúng 1
Bình luận (1)
Cho 11,2 (g) Fe tác dụng vừa đủ với dung dịch HCl. Sau phản ứng thu được sản phẩm gồm m (g) FeCl2 và V (ml) khí hyđrogen ở đktc. Tính m và V, biết PTHH xảy ra: Fe + HCl −−→ FeCl2 + H2
\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
0,2------------>0,2----->0,2
=> \(\left\{{}\begin{matrix}m_{FeCl_2}=0,2.127=25,4\left(g\right)\\V_{H_2}=0,2.22,4=4,48\left(l\right)\end{matrix}\right.\)
Đúng 5
Bình luận (0)
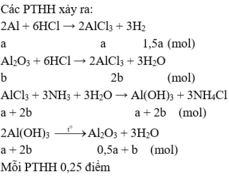
Cho 1,56 gam hỗn hợp gồm Al và
A
l
2
O
3
phản ứng hết với dung dịch HCl (dư), thu được V lít khí
H
2
(đktc) và dung dịch X. Nhỏ từ từ dung dịch
N
H
3
đến dư vào dung dịch X thu được kết tủa, lọc hết lượng kết tủa, nung đến khối lượng không đổi thu được 2,04 gam chất rắn. Viết các PTHH xảy ra và tính giá trị của V
Đọc tiếp
Cho 1,56 gam hỗn hợp gồm Al và A l 2 O 3 phản ứng hết với dung dịch HCl (dư), thu được V lít khí H 2 (đktc) và dung dịch X. Nhỏ từ từ dung dịch N H 3 đến dư vào dung dịch X thu được kết tủa, lọc hết lượng kết tủa, nung đến khối lượng không đổi thu được 2,04 gam chất rắn. Viết các PTHH xảy ra và tính giá trị của V
cho 5,4 g Al tác dụng với dung dịch HCl sau phản ứng thu được dung dịch AlCl3 và khí H2 .Tính khối lượng AlCl3 .Tính thế tích khoing khí ở đktc cần dụng để đốt cháy hest lượng khí hiđro trên
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
Theo PTHH: \(n_{AlCl_3}=n_{Al}=0,2\left(mol\right)\)
\(\Rightarrow m_{AlCl_3}=0,2.133,5=26,7\left(g\right)\)
Theo PTHH: \(n_{H_2}=\dfrac{0,2.3}{2}=0,3\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,3.22,4=6,72\left(l\right)\)
Đúng 2
Bình luận (1)
Dẫn V(l) khí CO2 vào dung dịch NaOH dư thu được m(g) muối. Cho tiếp lượng dư dung dịch HCl vào dung dịch trên thu được 4,48(l) khí ở đktc.
a) viết phương tình phản ứng.
b) Tính giá trị V và m
PTHH:
CO2 + NaOH ---> Na2CO3 + H2O. (1)
2HCl + Na2CO3 ---> 2NaCl + H2O + CO2. (2).
HCl + NaOH ---> NaCl + H2O
Theo pt(1) n Na2CO3 = n CO2 = 4,48: 22,4=0,2(mol)
---> m=m Na2CO3 = 0,2 . 106= 21,2 (g)
Theo pt(1) n CO2 = n Na2CO3 = 0,2 (mol)
---> V= V CO2= 0,2 . 22,4= 4,48 (l)
Đúng 0
Bình luận (0)
Cho 16,2 g Al tác dụng vừa đủ với dung dịch hỗn hợp H2SO4 6,694% và HCl x%. Sau phản ứng thu được V lít khí H2 (đktc) và dung dịch A trong đó nồng độ phần trăm của muối Al2(SO4)3 bằng 7,6%. a. Tìm V, x. b. Tính nồng độ phần trăm AlCl3 dung dịch A.