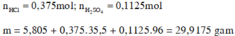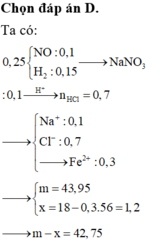X là hỗn hợp bột sắt và bột kim loại M có hóa trị II, lấy theo tỷ lệ khối lượng tương ứng là 7:12.
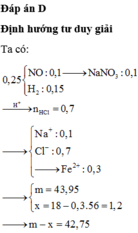
1.Nếu cho m gam X vào a gam dung dịch axit H2SO4 80% đun nóng thì các chất phản ứng với nhau vừa hết, có khí sunfurơ duy nhất bay ra. Từ dung dịch sau phản ứng này thu được 88 gam muối khan.
2. Nếu đổ thêm 3a gam nước vào a gam dd H2SO4 nói trên rồi cho tiếp m gam X vào khuấy kỹ cho phản ứng hoàn toàn thì sau khi tách kim loại M không tan còn lại dd B. Cho từ từ bột Na2CO3 vào dd B và khuấy đều cho đến khi ngừng thoát khí được dd D. Khối lượng dd D so với khối lượng dd B tăng thêm 62 gam.
Hãy: a. Xác định giá trị của m. b. Xác định kim loại M c. Tính nồng độ % các chất trong dd D.