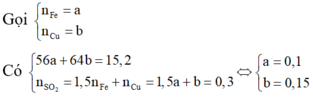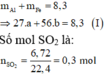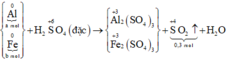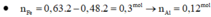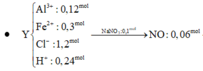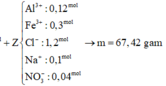Bài 1:Cho 6,14 gam hỗn hợp hai kim loại kẽm và sắt vào 200ml dung dịch sunfuric(H2SO4) đặc,nóng thấy thoát ra 2,688 lít khí sunfurơ (SO2) là sản phẩm khử duy nhất và hỗn hợp muối.
a)Tính khối lượng từng kim loại trong hỗn hợp đầu.
b)Dẫn 3/4 lượng khí trên vào dd NaOH 1M.Tính thể tích dd NaOH cần dùng để thu được 2 muối,trong đó số mol muối axit gấp 2 lần số mol muối trung hoà.