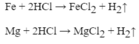Cho 2,4g Mg vào dung dịch HCl 100% ; 1.Viết Phương trình hóa học 2.Tính thể tích H2 (đktc) 3.Tính khối lượng dung dịch HCl 100%

Những câu hỏi liên quan
Cho 2,4g Mg vào dung dịch HCL loãng. Tính khối lượng MgCL2 tạo thành và thể tích khí H2 thoát ra ở đkc
\(n_{Mg}=\dfrac{2,4}{24}=0,1\left(mol\right)\)
PTHH :
\(Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\)
0,1 0,1 0,1
\(m_{MgCl_2}=0,1.95=9,5\left(g\right)\)
\(V_{H_2}=0,1.24,79=2,479\left(l\right)\)
Đúng 2
Bình luận (0)
Ta có: \(n_{Mg}=\dfrac{2,4}{24}=0,1\left(mol\right)\)
PT: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
Theo PT: \(n_{MgCl_2}=n_{H_2}=n_{Mg}=0,1\left(mol\right)\)
\(\Rightarrow m_{MgCl_2}=0,1.95=9,5\left(g\right)\)
\(V_{H_2}=0,1.24,79=2,479\left(l\right)\)
Đúng 3
Bình luận (0)
Bt2: hoà tan hoàn toàn 2,4g Mg vào dung dịch HCl a/ Viết PTHH của phản ứng b/ Tính thể tích hiđro thu được ở đktc,c/ dẫn hết lượng hiđro ở trên qua 32g một oxit của kim loại A có hoá trị không đổi, nung nóng thì vừa đủ. Tìm CTHH của Oxit
Mg+2HCl->MgCl2+H2
0,1---0,2-----0,1------0,1
n Mg=0,1 mol
=>VH2=0,1.22,4=2,24l
c)
ta đặt kim loại hóa trị 1 là A2O
A2O+H2-to>2A+H2O
ta có :\(\dfrac{32}{A.2+16}=0,1\)
=>A=152n
=>Vô lí
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn 2,4g kim loại Mg vào 100ml dung dịch HCl. (4đ)
a) Tính thể tích khí H2 bay ra ở đkc.
b) Tính nồng độ mol của dung dịch HCl.
c) Tính khối lượng muối thu được.
(Mg = 24, H = 1, Cl = 35,5
Mg+ 2HCl→ MgCl2+ H2
(mol) 0,1 0,2 0,1 0,1
a) \(n_{Mg}=\dfrac{m}{M}=\dfrac{2,4}{24}=0,1\left(mol\right)\)
→\(V_{H_2}=n.22,4=0,1.22,4=2,24\left(lít\right)\)
b) Đổi: 100ml=0,1 lít
\(C_{M_{HCl}}=\dfrac{n}{V}=\dfrac{0,2}{0,1}=2M\)
c) \(m_{MgCl_2}=n.M=0,1.95=9,5\left(g\right)\)
Đúng 1
Bình luận (0)
Cho 2,4g mg tác dụng vừa đủ với 200g dung dịch HCl. Hãy tính: a) thể tích H2 thoát ra ở điều kiện tiêu chuẩn? b) nồng độ % của dung dịch axit HCl đã dùng? ( cho biết: O= 16; H= 1; Mg= 24; Cl= 35,5 )
PTHH: \(Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\)
Ta có: \(n_{Mg}=\dfrac{2,4}{24}=0,1\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{HCl}=0,2\left(mol\right)\\n_{H_2}=0,1\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}C\%_{HCl}=\dfrac{0,2\cdot36,5}{200}\cdot100\%=3,65\%\\V_{H_2}=0,1\cdot22,4=2,24\left(l\right)\end{matrix}\right.\)
Đúng 1
Bình luận (0)
Cho 2,4g Mg tác dụng với dung dịch HCl 20% . Tính nồng độ % sau phản ứng
\(n_{Mg}=\frac{2,4}{24}=0,1\left(mol\right)\)
\(Mg+2HCl->MgCl_2+H_2\left(1\right)\)
theo (1) \(n_{MgCl_2}=n_{Mg}=0,1\left(mol\right)\) => \(m_{MgCl_2}=0,1.95=9,5\left(g\right)\)
theo (1) \(n_{HCl}=2n_{Mg}=0,2\left(mol\right)\) => \(m_{HCl}=0,2.36,5=7,3\left(g\right)\)
=> khối lượng dung dịch HCl là : 7,3 : 20% = 36,5 (g)
theo (1) \(n_{H_2}=n_{Mg}=0,1\left(mol\right)\) => \(m_{H_2}=0,1.2=0,2\left(g\right)\)
khối lượng dung dịch sau phản ứng là
\(2,4+36,5-0,2=38,7\left(g\right)\)
nồng độ % dung dịch sau phản ứng là \(\frac{9,5}{38,7}.100\%=24,55\%\)
Đúng 0
Bình luận (0)
\(n_{Mg}=\frac{2,4}{24}=0,1\left(mol\right)\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
0,1 mol 0,2mol 0,1 mol 0,1 mol \(m_{MgCl_2}=0,1.95=9,5\left(g\right)\)
\(m_{HCl}=0,2.36,5=7,3\left(g\right)\)
Khối lượng dung dịch HCl là:
\(m_{d_2}=\frac{7,3}{20\%}=36,5\left(g\right)\)
Khối lượng dung dịch sau phản úng là
\(m_{d_2}=2,4+36,5-0,1.2=38,7\left(g\right)\)
\(C\%=\frac{9,5}{38,7}.100\%=24,55\%\)
Đúng 0
Bình luận (0)
Hòa tan 11,2g Fe và 2,4g Mg tác dụng vừa đủ với 109,5g dung dịch HCl. Tính nồng độ % của dung dịch HCl đã dùng.
Cho 2,4g kim loại Mg tác dụng vừa đủ với 100ml dung dịch axit HCl thu được m gam muối và V lít H2 (đktc)
a) Xác định giá trị của m, V?
b) Tính nồng độ mol của dung dịch HCl?
nMg = 0,1(mol)
PTHH: Mg + 2HCl --> MgCl2 +H2
nMg = nMgCl2= nH2 = 0,1(mol)
=> mmuối = 9,5(g)
VH2 = 2,24(l)
b) CMHCl = 0,2/0,1=2(M)
Đúng 1
Bình luận (0)
cho 2,4g Mg tác dụng với 36.5g dung dịch HCl 10%.
tính C%, Cm các chất tan của dung dịch sau phản ứng biết D dung dịch=0,188 g/mol
\(PTHH:\)
\(Mg+2HCl--->MgCl_2+H_2\)
\(nMg=\dfrac{2,4}{24}=0,1(mol)\)
\(mHCl=\dfrac{C\%HCl.mddHCl}{100}=\dfrac{10.36,5}{100}=3,65\left(g\right)\)
\(nHCl=\dfrac{3,65}{36,5}=0,1(mol)\)
So sánh: \(\dfrac{nH_2}{1}=0,1>\dfrac{nHCl}{2}=0,05\)
=> Mg còn dư sau phản ứng, chọn nHCl để tính
Theo PTHH: \(nH_2=\dfrac{1}{2}.nHCl=0,05(mol)\)
\(=> mH_2=0,05.2=0,1(g)\)
\(m dd sau = mMg+mddHCl-mH_2\)
\(=> m dd sau = 2,4+36,5-0,1=38,8(g)\)
Dung dich sau phản ứng là MgCl2
Theo PTHH: \(nMgCl_2=\dfrac{1}{2}.nHCl=0,05(mol)\)
\(=> mMgCl_2=0,05.95=4,75(g)\)
\(C\%MgCl_2=\dfrac{4,75.100}{38,8}=12,24\%\)
Ta có: \(C_M=\dfrac{10.C\%.D}{M}\)
\(<=> C_MMgCl_2=\dfrac{10.12,24.0,188}{95}=0,24M\)
Đúng 0
Bình luận (0)
Cho 2,4g Mg tác dụng với 200ml dung dịch HCl
a) tính thể tích của hiđrô ở đktc
b) tính nồng độ của dung dịch HCl
Giúp ạk
nMg=2,4/24=0,1mol
PTPU:
Mg+ 2HCl->MgCl\(_2\)+H2
0,1....0,2........0,1.......0,1(mol)
n\(_{H_2}\)=0,1 mol
V\(_{H_2}\)=0,1.22,4=2,24l
b)n\(_{HCl}\)=0,2mol
C\(_M\)ddHCl=0,2/0,2=1M
Đúng 0
Bình luận (0)