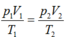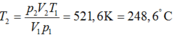áp suất của hỗn hợp khí trong xilanh của một động cơ vào cuối thời kỳ nén là bao nhiêu biết rằng trong quá trình nén nhiệt độ tăng từ 40 độ C đến 270 độ C thể tích giảm từ 0,9 lít 0,15 lít áp suất ban đầu là 6.10^4 N/m²

Những câu hỏi liên quan
Trong xilanh của một động cơ có chứa một lượng khí nhiệt độ 40 độ C và áp suất 0,6atm . Sau khi bị nén , thể tích của khí giảm đi 4 lần và áp suất tăng lên tới 5atm . Tính nhiệt độ của khí ở cuối quá trình trên .
Trạng thái 1: \(\left\{{}\begin{matrix}p_1=0,6atm\\V_1\\T_1=40^oC=313K\end{matrix}\right.\)
Trạng thái 2: \(\left\{{}\begin{matrix}p_2=5atm\\V_2=\dfrac{1}{4}V_1\\T_2=???\end{matrix}\right.\)
Quá trình khí lí tưởng:
\(\dfrac{p_1V_1}{T_1}=\dfrac{p_2V_2}{T_2}\Rightarrow\dfrac{0,6\cdot V_1}{313}=\dfrac{5\cdot\dfrac{1}{4}V_1}{T_2}\)
\(\Rightarrow T_2=652,083K=379,083^oC\)
Đúng 4
Bình luận (0)
Ở thời kì nén của một động cơ đốt trong 4 kì,nhiệt độ của hỗn hợp khí tăng từ 47 độ C đến 367 độ C,còn thể tích của khí giảm từ 1,8 lít đến 0,3 lít.Áp suất của khí lúc bắt đầu nén là 100kPa.Coi hỗn hợp khí như chất khí thuần nhất.Độ tăng áp suất? Đáp số:(1,1.106Pa)
Chọn tráng thái 1 là trạng thái đầu chưa nén.
\(t_1=47^0\Rightarrow T_1=47+273=320K.\)
\(V_1=1,8l.\)
\(P_1=100kPa.\)
Trạn thái 2 là trạng thái cuối cùng sau 4 chu kì.
\(t_2=367^0\Rightarrow T_2=367+273=640K.\)
\(V_2=0,3l.\)
\(P_2\)
Áp dụng phương trình trạng thái cho khí lí tưởng ta có
\(\frac{P_1V_1}{T_1}=\frac{P_2V_2}{T_2}\)
=> \(P_2=\frac{P_1V_1.T_2}{V_2T_1}=\frac{100.1,8.640}{0.3.320}=1200kPa.\)
Độ tăng áp suất là \(\Delta V=V_2-V_1=1200-100=1100kPa=1,1.10^6Pa.\)
Đúng 1
Bình luận (0)
Trước khi nén hỗn hợp khí trong xilanh của một động cơ có áp suất 1atm, nhiệt độ 50°C, thể tích xilanh là 600cm³. Sau khi nén thể tích giảm xuống còn 100cm³, áp suất là 8atm. Tính nhiệt độ khí sau khi nén?
600cm3 = 0,6l
100cm3 = 0,1l
Ta có
\(\dfrac{p_1V_1}{T_1}=\dfrac{p_2V_2}{T_2}\\ \Rightarrow T_2=\dfrac{p_2V_2.T_1}{p_1V_1}=\dfrac{8.0,1.323}{1.0,6}=430,6^oK\\ \Rightarrow t=157,6^o\)
Đúng 1
Bình luận (0)
Trong xilanh của một động cơ có chứa một lượng khí ở nhiệt độ 470C và áp suất 0,7 atm.Sau khi bị nén thể tích của khí giảm đi 5 lần và áp suất tăng lên tới 8 atm. Tính nhiệt độ của khí ở cuối quá trình nén? A. 7310C B. 320 K C. 3200C D. 731K
Đọc tiếp
Trong xilanh của một động cơ có chứa một lượng khí ở nhiệt độ 470C và áp suất 0,7 atm.Sau khi bị nén thể tích của khí giảm đi 5 lần và áp suất tăng lên tới 8 atm. Tính nhiệt độ của khí ở cuối quá trình nén?
A. 7310C
B. 320 K
C. 3200C
D. 731K
Đáp án D
TT1
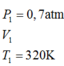
TT2

áp dụng PTTT khí lí tưởng
ta có:
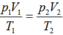
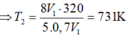
Đúng 0
Bình luận (0)
Trong xi lanh của một động cơ đốt trong có 2 lít hỗn hợp khí áp dưới áp suất 2 atm và nhiệt độ
27
°
C
. Pittông nén xuống làm cho thể tích của hỗn hợp khí chỉ còn bằng 0,2 lít và áp suất tăng lên tới 25 atm. Tính nhiệt độ của hỗn hợp khí nén. A.
77
°
C
B.
102
°
C
C.
217
°
C
D.
277
°
C
Đọc tiếp
Trong xi lanh của một động cơ đốt trong có 2 lít hỗn hợp khí áp dưới áp suất 2 atm và nhiệt độ 27 ° C . Pittông nén xuống làm cho thể tích của hỗn hợp khí chỉ còn bằng 0,2 lít và áp suất tăng lên tới 25 atm. Tính nhiệt độ của hỗn hợp khí nén.
A. 77 ° C
B. 102 ° C
C. 217 ° C
D. 277 ° C
Trong xi lanh của một động cơ đốt trong có 2 lít hỗn hợp khí áp dưới áp suất 1,5 atm và nhiệt độ 27 ° C. Pittông nén xuống làm cho thể tích của hỗn hợp khí chỉ còn bằng 0,3 lít và áp suất tăng lên tới 18 atm. Tính nhiệt độ của hỗn hợp khí nén.
Trong xi lanh của một động cơ đốt trong có 2 lít hỗn hợp khí áp dưới áp suất 2 atm và nhiệt độ
27
°
C. Pittông nén xuống làm cho thể tích của hỗn hợp khí chỉ còn bằng 0,2 lít và áp suất tăng lên tới 25 atm. Tính nhiệt độ của hỗn hợp khí nén A.
77
°
C B.
102
°
C C.
217...
Đọc tiếp
Trong xi lanh của một động cơ đốt trong có 2 lít hỗn hợp khí áp dưới áp suất 2 atm và nhiệt độ 27 ° C. Pittông nén xuống làm cho thể tích của hỗn hợp khí chỉ còn bằng 0,2 lít và áp suất tăng lên tới 25 atm. Tính nhiệt độ của hỗn hợp khí nén
A. 77 ° C
B. 102 ° C
C. 217 ° C
D. 277 ° C
Trước khi nén hỗn hợp khí trong xilanh của một động cơ có áp suất 1at, nhiệt độ 400C. Sau khi nén thể tích giảm đi 6 lần, áp suất 10at. Tìm nhiệt độ sau khi nén? A. 4000C B. 521,60C C. 248,60C D. 3130C
Đọc tiếp
Trước khi nén hỗn hợp khí trong xilanh của một động cơ có áp suất 1at, nhiệt độ 400C. Sau khi nén thể tích giảm đi 6 lần, áp suất 10at. Tìm nhiệt độ sau khi nén?
A. 4000C
B. 521,60C
C. 248,60C
D. 3130C
Trong xi lanh của một động cơ đốt trong có 2 lít hỗn hợp khí áp dưới áp suất 1,5 atm và nhiệt độ 270C. Pittông nén xuống làm cho thể tích của hỗn hợp khí chỉ còn bằng 0,3 lít và áp suất tăng lên tới 18 atm. Tính nhiệt độ của hỗn hợp khí nén.
Ta có
TH1 { V 1 = 2 l p 1 = 1 , 5 a t m T 1 = 27 + 273 = 300 K
TH2 { V 2 = 0 , 3 l p 2 = 18 a t m T 2 = ?
Áp dụng
p 1 V 1 T 1 p 2 V 2 T 2 ⇒ T 2 = p 2 V 2 T 1 p 1 V 1 = 18.0 , 3.300 1 , 5.2 T 2 = 540 K
Mà T 2 = 273 + t 2 ⇒ t 2 = 267 0 C
Đúng 0
Bình luận (0)