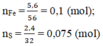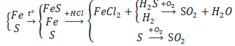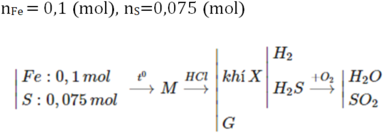Cho hỗn hợp gồm 5,6 Fe và 17,6g bột sắt tác dụng với dd HCl dư thu được V lít khí , Tính V ?

Những câu hỏi liên quan
Cho hỗn hợp gồm 5,6 gam fe và 4,8 gam mg tác dụng hoàn toàn với dd hcl dư sinh ra V lít khí h2(đktc)
a) tính thể tích khí thoát ra ở đktc?
b)tính thể tích dd hcl2m cần dùng?
c)tính khối lượng muối thu được sau phản ứng
\(a)n_{Fe}=\dfrac{5,6}{56}=0,1mol\\ n_{Mg}=\dfrac{4,8}{24}=0,2mol\\ Fe+2HCl\rightarrow FeCl_2+H_2\)
0,1 0,2 0,1 0,1
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
0,2 0,4 0,2 0,2
\(V_{H_2}=\left(0,1+0,2\right).22,4=6,72l\\ b)V_{ddHCl}=\dfrac{0,2+0,4}{2}=0,3l\\ c)m_{muối}=0,1.127+95.0,2=31,7g\)
Đúng 2
Bình luận (0)
Cho hỗn hợp gồm Na và Fe pứ hết với dd HCl dư,thu được V lít khí H2 .Nếu cho kim loại M (hóa trị 2 không đổi) có khối lượng bằng một nửa tổng khối lượng Na và Fe tác dụng hết với dd HCl dư thì cũng thu được V lít khí H2.Xác định kim loại M.Biết các khí đo cùng điều kiện về nhiệt độ và áp suất.
Mn giúp em với ạ. E đang cần gấp,em cảm ơn nhiều ạ
cho 1 93 gam hỗn hợp gồm fe và al tác dụng vừa đủ hới 1,28 g bột s thu được chất rắn xa. viết pthhb. tính khối lượng mỗi kim loại ban đầuc. cho chất rắn x tác dụng với hcl dư thu được v lít khí y . tìm v
Xem chi tiết
a) Đặt \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Al}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow56a+27b=1,93\) (1)
Ta có: \(n_S=\dfrac{1,28}{32}=0,04\left(mol\right)\)
Bảo toàn electron: \(2a+3b=0,08\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=\dfrac{121}{3800}\left(mol\right)\\b=\dfrac{31}{5700}\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Fe}=\dfrac{121}{3800}\cdot56\approx1,78\left(g\right)\\m_{Al}\approx0,15\left(g\right)\end{matrix}\right.\)
b) Bảo toàn nguyên tố: \(\Sigma n_{H_2S}=n_{FeS}+3n_{Al_2S_3}=n_{Fe}+6n_{Al}=\dfrac{49}{760}\left(mol\right)\)
\(\Rightarrow V_{H_2S}=\dfrac{49}{760}\cdot22,4\approx1,44\left(l\right)\)
Đúng 4
Bình luận (3)
Câu 3: Hòa tan hoàn toàn 36,8 gam hỗn hợp X gồm Fe, Fe3O4 và CuO trong dd HCl dư thu được dd A và
2,24 lít khí H2 (đktc). Dẫn khí H2S dư vào dd A thu được 12,8 gam kết tủa. Nếu cho hỗn hợp X trên tác dụng
với axit H2SO4 đặc, nóng, dư thì tạo ra V lít khí SO2 (sản phẩm khử duy nhất và đo ở đktc). Các p/ư xảy ra
hoàn toàn.
Viết các phương trình hóa học của các p/ư xảy ra và xác định chất khử, chất oxi hóa trong các p/ư đó.
Tính giá trị của V
Đọc tiếp
Câu 3: Hòa tan hoàn toàn 36,8 gam hỗn hợp X gồm Fe, Fe3O4 và CuO trong dd HCl dư thu được dd A và 2,24 lít khí H2 (đktc). Dẫn khí H2S dư vào dd A thu được 12,8 gam kết tủa. Nếu cho hỗn hợp X trên tác dụng với axit H2SO4 đặc, nóng, dư thì tạo ra V lít khí SO2 (sản phẩm khử duy nhất và đo ở đktc). Các p/ư xảy ra hoàn toàn. Viết các phương trình hóa học của các p/ư xảy ra và xác định chất khử, chất oxi hóa trong các p/ư đó. Tính giá trị của V
Cho 6g hỗn hợp A gồm 2 kim loại sắt và đồng hòa tan vào 500ml dd HCL 2M dư thu được V1 lít khí H2,dd B và 3,2 gam chất rắn Cho 6g hỗn hợp A tác dụng với dung dịch H2SO4 đặc nóng dư thu được V2 lít khí
a, Tính khối lượng sắt và đồng trong hỗn hợp A. Tính V1 và V2
b, Tính Cm các chất trong dung dịch B coi thể tích dung dịch ko thay đổi đáng kể
a) mCu = 3,2 (g)
=> mFe = 6 - 3,2 = 2,8 (g)
\(n_{Fe}=\dfrac{2,8}{56}=0,05\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
0,05->0,1--->0,05--->0,05
=> V1 = 0,05.22,4 = 1,12 (l)
\(n_{Cu}=\dfrac{3,2}{64}=0,05\left(mol\right)\)
PTHH: 2Fe + 6H2SO4(đ/n) --> Fe2(SO4)3 + 3SO2 + 6H2O
0,05--------------------------------->0,075
Cu + 2H2SO4 --> CuSO4 + SO2 + 2H2O
0,05------------------------>0,05
=> V2 = (0,075 + 0,05).22,4 = 2,8 (l)
b)
nHCl(dư) = 0,5.2 - 0,1 = 0,9 (mol)
=> \(\left\{{}\begin{matrix}C_{M\left(HCl.dư\right)}=\dfrac{0,9}{0,5}=1,8M\\C_{M\left(FeCl_2\right)}=\dfrac{0,05}{0,5}=0,1M\end{matrix}\right.\)
Đúng 1
Bình luận (0)
Nung 5,6 gam bột sắt với 2,4 gam bột lưu huỳnh trong điều kiện không có không khí, thu được chất rắn A. Cho A tác dụng với dd HCl 1M dư thu được hỗn hợp khí B. Tính:
a) Thể tích dd HCl đã phản ứng
b) Thể tích khí B ở ĐKTC
a)
\(n_{Fe} = \dfrac{5,6}{56} = 0,1(mol)\\ n_S = \dfrac{2,4}{32} = 0,075(mol)\)
Fe + S \(\xrightarrow{t^o}\) FeS
0,075.......0,075,,,,,,0,075...................(mol)
nFe dư = 0,1 - 0,075 = 0,025(mol)
Fe + 2HCl → FeCl2 + H2
0,025.....0,05..........................0,025............(mol)
FeS + 2HCl → FeCl2 + H2S
0,075.........0,15...........................0,075.............(mol)
\(\Rightarrow V_{dd\ HCl} = \dfrac{0,05+0,15}{1} = 0,2(lít)\)
b) VB = (0,025 + 0,075).22,4 = 2,24(lít)
Đúng 3
Bình luận (0)
Trộn 5,6 gam bột sắt với 2,4 gam bột lưu huỳnh rồi nung nóng (trong điều kiện không có không khí), thu được hỗn hợp rắn M. Cho M tác dụng với lượng dư dung dịch HCl, giải phóng hỗn hợp khí X và còn lại một phần không tan G. Để đốt cháy hoàn toàn X và G cần vừa đủ V lít khí O2 (ở đktc). Giá trị của V là: A. 2,80 B. 3,36 C. 3,08 D. 4,48.
Đọc tiếp
Trộn 5,6 gam bột sắt với 2,4 gam bột lưu huỳnh rồi nung nóng (trong điều kiện không có không khí), thu được hỗn hợp rắn M. Cho M tác dụng với lượng dư dung dịch HCl, giải phóng hỗn hợp khí X và còn lại một phần không tan G. Để đốt cháy hoàn toàn X và G cần vừa đủ V lít khí O2 (ở đktc). Giá trị của V là:
A. 2,80
B. 3,36
C. 3,08
D. 4,48.
Đáp án A
F e + S ⇒ M : F e , S , F e S → + H C l F e 2 + X : H 2 S , H 2 ; G : S → + O 2 H 2 O , S O 2
Có 3 chất thay đổi số oxi hóa là Fe, S và Oxi
Bảo toàn e: 4nO2 = 2nFe + 4nSO2 = 2. 0,1 + 4. 0,75= 0,5 mol
=> nO2 = 0,125 mol => V=2,8lít
Đúng 0
Bình luận (0)
Trong 5,6 gam bột sắt với 2,4 gam bột lưu huỳnh rồi nung nóng (trong điều kiện không có không khí), thu được hỗn hợp rắn M. Cho M tác dụng với lượng dư dung dịch HCl, giải phóng hỗn hợp khí X và còn lại một phần không tan G. Để đốt cháy hoàn toàn X và G cần vừa đủ V lít khí
O
2
(đktc). Giá trị của V là A. 2,80 B. 3,36 C. 3,08 D. 4,48
Đọc tiếp
Trong 5,6 gam bột sắt với 2,4 gam bột lưu huỳnh rồi nung nóng (trong điều kiện không có không khí), thu được hỗn hợp rắn M. Cho M tác dụng với lượng dư dung dịch HCl, giải phóng hỗn hợp khí X và còn lại một phần không tan G. Để đốt cháy hoàn toàn X và G cần vừa đủ V lít khí O 2 (đktc). Giá trị của V là
A. 2,80
B. 3,36
C. 3,08
D. 4,48
Trong 5,6 gam bột sắt với 2,4 gam bột lưu huỳnh rồi nung nóng (trong điều kiện không có không khí), thu được hỗn hợp rắn M. Cho M tác dụng với lượng dư dung dịch HCl, giải phóng hỗn hợp khí X và còn lại một phần không tan G. Để đốt cháy hoàn toàn X và G cần vừa đủ V lít khí O2(đktc). Giá trị của V là: A. 2,80 B. 3,36 C. 3,08 D. 4,48
Đọc tiếp
Trong 5,6 gam bột sắt với 2,4 gam bột lưu huỳnh rồi nung nóng (trong điều kiện không có không khí), thu được hỗn hợp rắn M. Cho M tác dụng với lượng dư dung dịch HCl, giải phóng hỗn hợp khí X và còn lại một phần không tan G. Để đốt cháy hoàn toàn X và G cần vừa đủ V lít khí O2(đktc). Giá trị của V là:
A. 2,80
B. 3,36
C. 3,08
D. 4,48