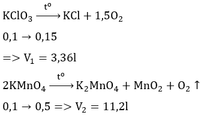Tính thể tích oxi (đktc) thu được khi phân hủy 4,9 gam KClO3 trong phòng thí nghiệm ?

Những câu hỏi liên quan
Để điều chế oxi trong phòng thí nghiệm người ta phân hủy kali clorat (KClO3) thu được kali clorua (KCl ) và khí oxi (O2).a. Tính thể tích khí oxi (đktc) thu được khi phân hủy 12,25 gam KClO3.b. Tính thể tích không khí chứa lượng oxi trên biết rằng c. Dùng toàn bộ lượng oxi trên cho tác dụng với 28 gam sắt. Sau phản ứng chất nào còn dư ? (Cho biết:K 39; Cl 35,5 ; O 16; Fe 56) Bài làm:
Đọc tiếp
Để điều chế oxi trong phòng thí nghiệm người ta phân hủy kali clorat (KClO3) thu được kali clorua (KCl ) và khí oxi (O2).
a. Tính thể tích khí oxi (đktc) thu được khi phân hủy 12,25 gam KClO3.
b. Tính thể tích không khí chứa lượng oxi trên biết rằng ![]() =
= ![]()
c. Dùng toàn bộ lượng oxi trên cho tác dụng với 28 gam sắt. Sau phản ứng chất nào còn dư ?
(Cho biết:K = 39; Cl = 35,5 ; O = 16; Fe = 56)
Bài làm:
a.\(n_{KClO_3}=\dfrac{m_{KClO_3}}{M_{KClO_3}}=\dfrac{12,25}{122,5}=0,1mol\)
\(2KClO_3\rightarrow\left(t^o\right)2KCl+3O_2\)
2 2 3 ( mol )
0,1 0,15
\(V_{O_2}=n_{O_2}.22,4=0,15.22,4=3,36l\)
b.\(V_{kk}=V_{O_2}.5=3,36.5=16,8l\)
c.\(n_{Fe}=\dfrac{m_{Fe}}{M_{Fe}}=\dfrac{28}{56}=0,5mol\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
3 2 1 ( mol )
0,5 > 0,15 ( mol )
0,225 0,15 ( mol )
\(m_{Fe\left(du\right)}=n_{Fe\left(du\right)}.M_{Fe}=\left(0,5-0,225\right).56=15,4g\)
Đúng 1
Bình luận (0)
Trong phòng thí nghiệm có thể dùng muối KClO3 hoặc KMnO4 để điều chế oxi bằng phản ứng phân hủy. Viết phương trình hóa học của các phản ứng và tính thể tích khí oxi thu được (đktc) khi nhiệt phân hoàn toàn 0,1 mol mỗi chất trên.
tính thể tích oxi(đkte)thu được sau khi phân hủy $,9 gam KCIO3 trong phòng thí nghiệm
\(n_{KClO_3}=\dfrac{4.9}{122,5}=0,04\left(mol\right)\)
2KClO3 ---to---> 2KCl + 3O2
0,04 0,06
\(V_{O_2}=0,06.22,4=1,344\left(l\right)\)
Đúng 1
Bình luận (1)
Xem thêm câu trả lời
Để điều chế khí oxi trong phòng thí nghiệm, người ta tiến hành phân hủy 24,5 gam kaliclorat KClO3 ở nhiệt độ cao.a) Tính thể tích khí oxi thu được ở điều kiện tiêu chuẩn.b) Lượng khí oxi thu được được dùng để oxi hóa hoàn toàn một lượng phôt pho đỏ (P) vừa đủ.Viết PTHH của phản ứng trên và tính khối lượng sản phẩm P2O5 thu được.c)Nếu dùng không khí để oxi hóa lượng P dùng ở phần (b) thì cần lấy bao nhiêu lít không khí? Biết rằng khí oxi chiếm ~ 20% thể tích không khí.
Đọc tiếp
Để điều chế khí oxi trong phòng thí nghiệm, người ta tiến hành phân hủy 24,5 gam kaliclorat KClO3 ở nhiệt độ cao.
a) Tính thể tích khí oxi thu được ở điều kiện tiêu chuẩn.
b) Lượng khí oxi thu được được dùng để oxi hóa hoàn toàn một lượng phôt pho đỏ (P) vừa đủ.
Viết PTHH của phản ứng trên và tính khối lượng sản phẩm P2O5 thu được.
c)Nếu dùng không khí để oxi hóa lượng P dùng ở phần (b) thì cần lấy bao nhiêu lít không khí? Biết rằng khí oxi chiếm ~ 20% thể tích không khí.
2KClO3-to>2KCl+3O2
0,2---------------------0,3
4P+5O2-to->2P2O5
--0,3-------0,12 mol
n KClO3=\(\dfrac{24,5}{122,5}=0,2mol\)
=>VO2=0,3.22,4=6,72l
=>m P2O5=0,12.142=17,04g
=>Vkk=6.72.5=33,6l
Đúng 2
Bình luận (0)
nKClO3 = 24,5 : 122,5 = 0,2 (mol)
pthh : 2KClO3 -t--> 2KCl +3 O2
0,2---------------------> 0,3(MOL)
VO2 = 0,3 .22,4 = 6,72 (L)
pthh : 4P+5O2-t--> 2P2O 5
0,3---> 0,12 (mol)
=> mP2O5 = 0,12 . 142 = 17,04 (g)
ta co : Vkk = VO2:21% = 6,72 : 21% 32 (l)
Đúng 1
Bình luận (1)
Những hợp chất nào sau đâycó thể dùng điều chế oxi trong phòng thí nhiệm:KMnO4,KClO3,KnO3,HgO.Tính thể tích khí oxi thu được(đktc)khi nung(khi phân hủy).
a.0,5 mol mỗi chất trên?
b.50g mỗi chất KnO3 hoặc HgO?
a)
2KMnO4 -to-> K2MnO4 + MnO2 + O2
0.5__________________________0.25
VO2 = 0.25*22.4 = 5.6 (l)
2KClO3 -to-> 2KCl + 3O2
0.5_______________0.75
VO2 = 0.75*22.4 = 16.8 (l)
2KNO3 -to-> 2KNO2 + O2
0.5________________0.25
VO2 = 0.25*22.4 = 5.6 (l)
2HgO -to-> 2Hg + O2
0.5____________0.25
VO2 = 0.25*22.4 = 5.6 (l)
b)
nKNO3 = 50/101 (mol)
2KNO3 -to-> 2KNO2 + O2
50/101______________25/101
VO2 = 25/101 * 22.4 = 5.54 (l)
nHgO = 50/217 (mol)
2HgO -to-> 2Hg + O2
50/217 _________25/217
VO2 = 2.58 (l)
Đúng 1
Bình luận (0)
Tính thể tích oxi thu được .
a, khi phân hủy 9,8g Kali clorat trong phòng thí nghiệm
b, khi điện phân 36Kg H2O trong công nghiệt
\(a) 2KClO_3 \xrightarrow{t^o,MnO_2} 2KCl +3 O_2\\ n_{O_2} = \dfrac{3}{2}n_{KClO_3} = \dfrac{3}{2}. \dfrac{9,8}{122,5} = 0,12(mol)\\ \Rightarrow V_{O_2} = 0,12.22,4 = 2,688(lít)\\ b) 2H_2O \xrightarrow{điện\ phân} 2H_2 + O_2\\ n_{O_2} = \dfrac{1}{2}n_{H_2O} = \dfrac{1}{2}. \dfrac{36.1000}{18} = 1000(mol)\\ \Rightarrow V_{O_2} = 1000.22,4 = 22400(lít)\)
Đúng 4
Bình luận (0)
\(â.\)
\(n_{KClO_3}=\dfrac{9.8}{122.5}=0.08\left(mol\right)\)
\(2KClO_3\underrightarrow{t^0}2KCl+3O_2\)
\(0.08........................0.12\)
\(V_{O_2}=0.12\cdot22.4=2.688\left(l\right)\)
\(b.\)
\(n_{H_2O}=\dfrac{36\cdot1000}{18}=2000\left(mol\right)\)
\(2H_2O\underrightarrow{t^0}2H_2+O_2\)
\(2000..................1000\)
\(V_{O_2}=1000\cdot22.4=22400\left(l\right)\)
Đúng 2
Bình luận (0)
Để điều chế khí oxi trong phòng thí nghiệm, đem nhiết phân KClO3
a, Nếu nung 3,675g KClO3 thì thể tích khí oxi thu được bao nhiêu lít ở đktc?
b, Nếu thu được 11,2 lít khí oxi ở đktc thì khối lượng KClO3 cần dùng là bao nhiêu g?
\(a.\)
\(n_{KClO_3}=\dfrac{3.675}{122.5}=0.03\left(mol\right)\)
\(2KClO_3\underrightarrow{t^0}2KCl+3O_2\)
\(0.03........................0.045\)
\(V_{O_2}=0.045\cdot22.4=1.008\left(l\right)\)
\(n_{O_2}=\dfrac{11.2}{22.4}=0.5\left(mol\right)\)
\(\Rightarrow n_{KClO_3}=\dfrac{0.5\cdot2}{3}=\dfrac{1}{3}mol\)
\(\Rightarrow m_{KClO_3}=\dfrac{1}{3}\cdot122.5=40.83\left(g\right)\)
Đúng 2
Bình luận (0)
Bài 2: Nhiệt phân 18,375 gam KClO3 trong phòng thí nghiệm, thu được KCl và khí oxi (O2). a. Viết phương trình hóa học của phản ứng trên? Cho biết phản ứng trên thuộc loại phản ứng gì? Vì sao? b. Tính thể tích khí O2 thu được ( ở đktc). c. Tính thể tích của không khí để chứa lượng oxi trên?Biết thể tích oxi bằng 1/5 lần thể tích không khí ( Biết: K 39; Cl 35,5; O 16;).
Đọc tiếp
Bài 2: Nhiệt phân 18,375 gam KClO3 trong phòng thí nghiệm, thu được KCl và khí oxi (O2).
a. Viết phương trình hóa học của phản ứng trên? Cho biết phản ứng trên thuộc loại phản ứng gì? Vì sao?
b. Tính thể tích khí O2 thu được ( ở đktc).
c. Tính thể tích của không khí để chứa lượng oxi trên?Biết thể tích oxi bằng 1/5 lần thể tích không khí
( Biết: K = 39; Cl = 35,5; O = 16;).
a. \(n_{KClO_3}=\dfrac{18.375}{122,5}=0,15\left(mol\right)\)
PTHH : 2KClO3 ----to---> 2KCl + 3O2
0,15 0,225
Phản ứng trên là phản ứng phân hủy . Vì phản ứng phân hủy là một phản ứng hóa học mà trong đó một chất tham gia có thể tạo thành hai hay nhiều chất mới.
b. \(V_{O_2}=0,225.22,4=5,04\left(l\right)\)
c. \(V_{kk}=5,04.5=25,2\left(l\right)\)
Đúng 2
Bình luận (0)
Trg phòng thí nghiệm. Khi điều chế khí oxi,người ta dùng 12,25g KCLO3. Hãy tính thể tích khí oxi thu được ở đktc. Biết hiệu suất pư dư đạt 80%
PTHH :
\(2KClO_3\overrightarrow{t^o}2KCl+3O_2\uparrow\)
\(n_{KClO_3}=\dfrac{12,25}{122,5}=0,1\left(mol\right)\)
Theo PTHH :
\(n_{O_2}=\dfrac{3}{2}n_{KClO_3}=0,15\left(mol\right)\)
\(V_{O_2}=0,15.22,4=3,36\left(l\right)\)
\(V_{O_{2thucte}}=3,36.80\%=2,688\left(l\right)\)
Đúng 2
Bình luận (2)
Để điều chế khí oxi trong phòng thí nghiệm, người ta nung nóng 55,125 gam kali clorat KClO3 ở nhiệt độ cao với chất
xúc tác MnO2. Tính thể tích khí oxi thu được ở đktc, biết hiệu suất của phản ứng đạt 85%.
\(n_{KClO_3\left(bd\right)}=\dfrac{55,125}{122,5}=0,45\left(mol\right)\)
=> \(n_{KClO_3\left(pư\right)}=\dfrac{0,45.85}{100}=0,3825\left(mol\right)\)
PTHH: 2KClO3 --to,MnO2--> 2KCl + 3O2
0,3825------------------->0,57375
=> \(V_{O_2}=0,57375.22,4=12,852\left(l\right)\)
Đúng 4
Bình luận (0)
2KClO3-to>2KCl+3O2
0,45---------------------0,675 mol
n KClO3=\(\dfrac{55,125}{122,5}\)=0,45 mol
=>H=85%
=>VO2=0,675.22,4.\(\dfrac{85}{100}\)=12,852l
Đúng 3
Bình luận (1)