Đốt cháy 12,4g P trong bình chứa 17g khí oxi tạo thành P2O5
a) P hay O2 chất nào còn dư? Khối lượng là bao nhiêu?
b) Tính khối lượng chất tạo thành
Đốt cháy 12,4g photpho trong bình chứa 17g khí oxi tạo thành P2O5
a) Photpho hay oxi chất nào còn thừa và số mol chất còn thừa là bao nhiêu?
b) Chất nào được tạo thành? Khối lượng là bao nhiêu?
\(n_P=\dfrac{m_p}{M_P}=\dfrac{12,4}{31}=0,4mol\)
\(n_{O_2}=\dfrac{m_{O_2}}{M_{O_2}}=\dfrac{17}{32}=0,53125mol\)
\(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
4 5 2 ( mol )
0,4 0,53125 ( mol )
ta có: \(\dfrac{0,4}{4}< \dfrac{0,53125}{5}\)
=> Chất dư là \(O_2\)
\(n_{O_2\left(du\right)}=0,53125-0,5=0,03125mol\)
Chất được tạo thành là \(P_2O_5\)
\(m_{P_2O_5}=n_{P_2O_5}.M_{P_2O_5}=\left(\dfrac{0,4.2}{4}\right).142=28,4g\)
Đốt cháy 12,4g P trong bình chứa 17g O tạo thành điphotpho pentaoxit (P2O5)
a) Photpho hay Oxi, chất nào còn dư và số mol chất còn dư là bao nhiêu?
b) Chất nào được tạo thành? Khối lượng là bao nhiêu?
a) $n_P = \dfrac{12,4}{31} = 0,4(mol) ; n_{O_2} = \dfrac{17}{32} = 0,53125(mol)$
$4P + 5O_2 \xrightarrow{t^o} 2P_2O_5$
Ta thấy :
$n_P : 4 < n_{O_2} : 5$ nên $O_2$ dư
$n_{O_2\ pư} = \dfrac{5}{4}n_P = 0,5(mol)$
$\Rightarrow n_{O_2\ dư} = 0,53125 - 0,5 = 0,03125(mol)$
b) Điphotpho pentaoxit được tạo thành
$n_{P_2O_5} = \dfrac{1}{2}n_P = 0,2(mol)$
$m_{P_2O_5} = 0,2.142 = 28,4(gam)$
Đốt cháy 12,4g photpho trong bình chứa 17g khí oxi tạo thành điphotpho pentaoxit P2O5 (là chất rắn, trắng).
a) Photpho hay oxi chất nào còn thừa và số mol chất còn thừa là bao nhiêu?
b) Chất nào được tạo thành? Khối lượng là bao nhiêu?
a)
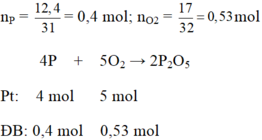
Xét tỉ lệ số mol đề bài với số mol phương trình của P và O2 ta có:

b) Chất tạo thành: đi photpho pentaoxit P2O5
Theo phương trình 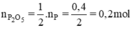
mP2O5 = n.M = 0,2.(31.2 + 16.5) = 28,4 (g)
Bài 4: Đốt cháy 12,4g photpho trong bình chứa 17g khí oxi tạo thành điphotpho pentaoxit P2O5 (là chất rắn, trắng).
a) Photpho hay oxi chất nào còn thừa và số mol chất còn thừa là bao nhiêu?
b) Chất nào được tạo thành? Khối lượng là bao nhiêu? Bài 5: Đốt cháy hoàn toàn 24kg than đá có chứa 0,5% tạp chất lưu huỳnh và 1,5% tạp chất khác không cháy được. Tính thể tích khí CO2 và SO2 tạo thành (ở điều kiện tiêu chuẩn).
Bài 4:
a) \(n_P=\dfrac{12,4}{31}=0,4\left(mol\right)\)
\(n_{O_2}=\dfrac{17}{32}=0,53125\left(mol\right)\)
PTHH: 4P + 5O2 --to--> 2P2O5
Xét tỉ lệ: \(\dfrac{0,4}{4}< \dfrac{0,53125}{5}\) => P hết, O2 dư
PTHH: 4P + 5O2 --to--> 2P2O5
0,4-->0,5--------->0,2
=> \(n_{O_2\left(dư\right)}=0,53125-0,5=0,03125\left(mol\right)\)
b) \(m_{P_2O_5}=0,2.142=28,4\left(g\right)\)
Đốt cháy 12,4 gam photpho trong bình chứa 17g khí oxi tạo thành điphotpho pentaoxit P2O5 (là chất rắn, trắng).
a. Photpho hay oxi, chất nào còn dư và số mol của chất còn dư là bao nhiêu?
b. Chất nào được tạo thành? Khối lượng là bao nhiêu?
\(n_P=\dfrac{m_P}{M_P}=\dfrac{12,4}{31}=0,4mol\)
\(n_{O_2}=\dfrac{m_{O_2}}{M_{O_2}}=\dfrac{17}{32}=0,53125mol\)
\(4P+5O_2\rightarrow\left(t^o\right)2P_2O_5\)
0,4 < 0,53125 ( mol )
0,4 0,5 0,2 ( mol )
\(n_{O_2\left(du\right)}=0,53125-0,5=0,03125mol\)
Chất được tạo thành là P2O5
\(m_{P_2O_5}=n_{P_2O_5}.M_{P_2O_5}=0,2.142=18,4g\)
Đốt cháy 12,4g P trong bình chứa 19,2g khí O2 tạo thành P2O5 .
a. P hay O2 dư ? Số mol chất dư là bao nhiêu ?
b. Tính khối lượng P2O5 tạo thành ?
Cho biết Cu = 64; S=32; O= 16; H=1
\(n_P=\dfrac{m}{M}=\dfrac{12,4}{31}=0,4\left(mol\right)\)
\(n_{O_2}=\dfrac{m}{M}=\dfrac{19,2}{32}=0,6\left(mol\right)\)
\(4P+5O_2\rightarrow^{t^0}2P_2O_5\)
4 : 5 : 2 (mol)
0,4 : 0,6 (mol)
-Lập tỉ lệ: \(\dfrac{0,4}{4}< \dfrac{0,6}{5}\Rightarrow\)O2 phản ứng hết còn P dư.
\(n_{P\left(lt\right)}=\dfrac{0,4.5}{4}=0,5\left(mol\right)\)
\(n_{P\left(dư\right)}=n_{P\left(tt\right)}-n_{P\left(lt\right)}=0,6-0,5=0,1\left(mol\right)\)
b. \(n_{P_2O_5}=\dfrac{0,4.2}{4}=0,2\left(mol\right)\)
\(\Rightarrow m_{P_2O_5}=n.M=0,2.142=28,4\left(g\right)\)
Đốt cháy 12,4g Photpho trong bình chứa oxi tạo thành sản phẩm điphotpho pentaoxit. a) Tính khối lượng hợp chất tạo thành. b) Nếu trong bình chứa 17g khí oxi. Hỏi sau khi phản ứng kết thúc chất nào dư và dư bao nhiêu gam?
\(n_P=\dfrac{12,4}{31}=0,4\left(mol\right)\\
pthh:4P+5O_2\underrightarrow{t^o}2P_2O_5\)
0,4 0,2
\(m_{P_2O_5}=142.0,2=28,4g\)
\(n_{O_2}=\dfrac{17}{32}=0,53\left(mol\right)\)
\(pthh:4P+5O_2\underrightarrow{t^o}2P_2O_5\\
LTL:\dfrac{0,4}{4}< \dfrac{0,53}{5}\)
=> O2 dư
\(n_{O_2\left(p\text{ư}\right)}=\dfrac{5}{4}n_P=0,5\left(mol\right)\\
m_{O_2\left(d\right)}=\left(0,53-0,5\right).32=0,96g\)
`4P + 5O_2` $\xrightarrow[]{t^o}$ `2P_2 O_5`
`0,4` `0,5` `0,2` `(mol)`
`n_P = [ 12,4 ] / 31 = 0,4 (mol)`
`a) m_[P_2 O_5] = 0,2 . 142 = 28,4 (g)`
`b) n_[O_2] = 17 / 32 = 0,53125 (mol)`
Ta có: `[ 0,4 ] / 4 < [ 0,53125 ] / 5`
`->O_2` dư
`=> m_[O_2 (dư)] = ( 0,53125 - 0,5 ) . 32 = 1(g)`
Đốt cháy 12,4gam photpho trong bình chứa 17g khí oxi tạo thành điphotphopenta oxit a) chất nào còn dư sau phản ứng và khối lượng là bao nhiêu b) tính khối lượng sản phẩm tạo thành
nP = 12.4/31 = 0.4 (mol)
nO2 = 17/32 (mol)
4P + 5O2 -t0-> 2P2O5
Bđ: 0.4....17/32
Pư: 0.4......0.5.............0.2
Kt: 0............1/32...........0.2
mO2(dư) = 1/32 * 32 = 1 (g)
mP2O5 = 0.2 * 142 = 28.4 (g)
Câu 6: Đốt cháy 12,4g Phosphorus trong bình chứa 18g khí Oxygen tạo thành Diphosphorus Pentoxide P2O5 .
a. Chất nào còn dư sau phản ứng ? Khối lượng chất dư là bao nhiêu ?
b. Chất nào được tạo thành ? Khói lượng là bao nhiêu ?
giúp tui với mai nộp rui ah :<
\(n_P=\dfrac{12,4}{31}=0,4\left(mol\right)\)
\(n_{O_2}=\dfrac{18}{32}=0,5625\left(mol\right)\)
PTHH :
\(4P+5O_2\rightarrow\left(t^o\right)2P_2O_5\)
0,4 0,5 0,2
\(\dfrac{0,4}{4}< \dfrac{0,5625}{5}\) --> O2 dư sau phản ứng
\(m_{O_2dư}=\left(0,5625-0,5\right).32=2\left(g\right)\)
P2O5 được tạo thành.
\(m_{P_2O_5}=0,2.142=28,4\left(g\right)\)
\(n_P=\dfrac{12,4}{31}=0,4\left(mol\right)\)
\(n_{O_2}=\dfrac{18}{32}=0,5625\left(mol\right)\)
PT: \(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
a, Xét tỉ lệ: \(\dfrac{0,4}{4}< \dfrac{0,5625}{5}\), ta được O2 dư.
Theo PT: \(n_{O_2\left(pư\right)}=\dfrac{5}{4}n_P=0,5\left(mol\right)\Rightarrow n_{O_2\left(dư\right)}=0,0625\left(mol\right)\)
\(\Rightarrow m_{O_2\left(dư\right)}=0,0625.32=2\left(g\right)\)
b, P2O5 được tạo thành.
Theo PT: \(n_{P_2O_5}=\dfrac{1}{2}n_P=0,2\left(mol\right)\)
\(\Rightarrow m_{P_2O_5}=0,2.142=28,4\left(g\right)\)
\(a.n_P=\dfrac{12,4}{31}=0,4mol\\ n_{O_2}=\dfrac{18}{32}=0,5625mol\\ 4P+5O_2\rightarrow2P_2O_5\\ \Rightarrow\dfrac{0,4}{4}< \dfrac{0,5625}{5}\Rightarrow O_2.dư\\ n_{O_2,pư}=\dfrac{0,4.5}{4}=0,5mol\\ m_{O_2.dư}=\left(0,5625-0,5\right).32=2g\\ b.Chất.tạo.thành:P_2O_5\\ n_{P_2O_5}=\dfrac{0,4.2}{4}=0,2mol\\ m_{P_2O_5}=0,2.142=28,4g\)
đốt cháy 12,4g photpho trong bình chứa 17 g oxi tạo thành điphotpho pentaoxit p2o5
A photpho hay oxi dư và số mol chất dư là bao nhiu
B chất nào được tạo thành khối lượng là bao nhiu
Số mol photpho và khí oxi lần lượt là 12,4:31=0,4 (mol) và 17:32=0,53125 (mol).
A) 4P (0,4 mol) + 5O2 (0,5 mol) \(\underrightarrow{t^o}\) 2P2O5 (0,2 mol).
0,4:4<0,53125:5 nên khí oxi dư và dư 0,53125-0,5=0,03125 (mol).
B) Điphotpho pentaoxit (P2O5) được tạo thành có khối lượng là 0,2.142=28,4 (g).