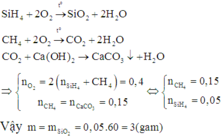Đốt cháy hoàn toàn 10,6 gam hỗn hợp khí C2H2, C3H4 trong oxi. Đem toàn bộ sản phẩm qua dung dịch Ca(OH)2 dư thu được 80g kết tủa. a. Viết các phương trình phản ứng. b. Tính khỗi lượng của mỗi khí trong hỗn hợp.

Những câu hỏi liên quan
1) Đốt cháy hoàn toàn hỗn hợp X gồm c2h2 ,c4h4 bằng oxi vừa đủ, sau pứ cho toàn bộ sản phẩm cháy qua dung dịch ca(oh)2 dư thì có 20 gam kết tủa. tính khối lượng X đã đem đốt cháy và thể tích khí oxi cần dùng (đktc)
Quy đổi C4H4 thành C2H2
\(n_{CaCO_3}=\dfrac{20}{100}=0,2\left(mol\right)\)
PTHH: 2C2H2 + 5O2 --to--> 4CO2 + 2H2O
0,1<--0,25<--------0,2
Ca(OH)2 + CO2 --> CaCO3 + H2O
0,2<------0,2
=> \(m_X=0,1.26=2,6\left(g\right)\)
\(V_{O_2}=0,25.22,4=5,6\left(l\right)\)
Đúng 2
Bình luận (0)
Hỗn hợp X gồm CH4 và c2h6 có tỉ khối so với hiđrô bằng 12,2 đốt cháy hoàn toàn 11,2l khí X hấp thụ hết toàn bộ sản phẩm vào dung dịch Ca(OH)2 dư thu được m gam kết tủa .viết các phương trình phản ứng xảy ra. tính khối lượng kết tủa thu được
Gọi số mol CH4, C2H6 là a, b (mol)
Có: \(\left\{{}\begin{matrix}a+b=\dfrac{11,2}{22,4}=0,5\left(mol\right)\\M_X=\dfrac{16a+30b}{a+b}=12,2.2=24,4\left(g/mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}a=0,2\left(mol\right)\\b=0,3\left(mol\right)\end{matrix}\right.\)
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
0,2---------------->0,2
2C2H6 + 7O2 --to--> 4CO2 + 6H2O
0,3----------------->0,6
Ca(OH)2 + CO2 --> CaCO3 + H2O
0,8---------------->0,8
=> mCaCO3 = 0,8.100 = 80 (g)
Đúng 3
Bình luận (0)
Đốt cháy hoàn toàn 11,2 lít khí Metan (CH4).
a. Viết phương trình phản ứng xảy ra
b. Tính thể tích Oxi cần dùng để đốt cháy lượng khí trên?
c. Dẫn toàn bộ khí sinh ra qua dung dịch nước vôi trong Ca(OH)2 dư thì thu được bao nhiêu gam kết tủa?
Thể tích các khí đo ở điều kiện tiêu chuẩn
(Cho biết : C=12; O=16; Ca=40; H=1; Br=80)
a, \(n_{CH_4}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
PTHH:
CH4 + 2O2 --to--> CO2 + 2H2O
0,5--->1------------->0,5
Ca(OH)2 + CO2 ---> CaCO3 + H2O
0,5----->0,5
b, \(V_{O_2}=1.22,4=22,4\left(l\right)\)
c, \(m_{CaCO_3}=0,5.100=50\left(g\right)\)
Đúng 3
Bình luận (0)
Hỗn hợp M gồm SiH4 và CH4. Đốt cháy hoàn toàn một lượng hỗn hợp M cần dùng vừa đủ 0,4 mol O2, thu được sản phẩm khí X và m gam sản phẩm rắn Y. Cho toàn bộ lượng X đi qua dung dịch Ca(OH)2 lấy dư, kết thúc phản ứng thu được 15 gam kết tủa. Giá trị của m là A. 3 B. 15 C. 6 D. 12
Đọc tiếp
Hỗn hợp M gồm SiH4 và CH4. Đốt cháy hoàn toàn một lượng hỗn hợp M cần dùng vừa đủ 0,4 mol O2, thu được sản phẩm khí X và m gam sản phẩm rắn Y. Cho toàn bộ lượng X đi qua dung dịch Ca(OH)2 lấy dư, kết thúc phản ứng thu được 15 gam kết tủa. Giá trị của m là
A. 3
B. 15
C. 6
D. 12
Đốt cháy hoàn toàn 4,48 lít (đktc) hỗn hợp khí X gồm CH4 và C2H6. Dẫn toàn bộ sản phẩm cháy vào dung dịch Ca(OH)2 dư, thu được 30 gam kết tủa.
a) Viết phương trình hóa học của các phản ứng xảy ra.
b) Tính thành phần phần trăm thể tích mỗi khí trong X.
\(n_{hh}=\frac{V}{22,4}=\frac{4,48}{22,4}=0,2\left(mol\right)\)
\(n_{CaCO_3}=\frac{m}{M}=\frac{30}{100}=0,3\left(mol\right)\)
Gọi x là số mol Ch4 ; y là số mol C2H6
\(CH_4+2O_2\rightarrow CO_2+2H_2O\)
x x
\(C_2H_6+\frac{7}{2}O_2\rightarrow2CO_2+3H_2O\)
y 2y
\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3+H_2O\)
0,3 0,3
Ta có hê phương trình
\(\hept{\begin{cases}x+y=0,2\\x+2y=0,3\end{cases}}\)
\(\Rightarrow\hept{\begin{cases}x=0,1\left(mol\right)\\y=0,1\left(mol\right)\end{cases}}\)
Vì Số mol hai chất bằng nhau nên thể tích hai chất cũng bằng nhau nên phần trăm thể tích mỗi chất là 50%
Xem thêm câu trả lời
chia hỗn hợp A gồm CH4 và C2H4 có khối lượng 3,2 gam thành hai phần không bằng nhau . Phần 1 : hấp thụ hết vào bình chứa dung dịch brom dư, sau phản ứng đã có 3,2 gam brom tham gia phản ứng. Phần 2: đốt cháy hoàn toàn trong khí oxi, rồi dẫn toàn bộ sản phẩm cháy vào dung dịch Ba(OH)2 dư thu được 32,505 gam kết tủa. a) viết các phản ứng xảy ra b) tính khối lượng CH4 trong A
Hỗn hợp khí A gồm CO và H2. Tiến hành các thí nghệm sau:- Đem đốt cháy hoàn toàn hỗn hợp khí A rồi cho sản phảm cháy vào dung dịch Ca(OH)2 dư thì thu được 20 gam kết tủa CaCO3. - Dẫn hỗn hợp khí A qua bột đồng CuO dư,nung nóng đến khi phản ứng kết thúc thì thu được 19.2 g kim loại Cu. 1. Viết phương trình phản ứng xảy ra.2. Tính thành phần trăm thể tích của hỗn hợp khí A
Đọc tiếp
Hỗn hợp khí A gồm CO và H2. Tiến hành các thí nghệm sau:
- Đem đốt cháy hoàn toàn hỗn hợp khí A rồi cho sản phảm cháy vào dung dịch Ca(OH)2 dư thì thu được 20 gam kết tủa CaCO3.
- Dẫn hỗn hợp khí A qua bột đồng CuO dư,nung nóng đến khi phản ứng kết thúc thì thu được 19.2 g kim loại Cu.
1. Viết phương trình phản ứng xảy ra.
2. Tính thành phần trăm thể tích của hỗn hợp khí A
CO+1/2O2------>CO2
x-----1/2x ----------x mol
H2 + CuO --------> Cu +H2O
0,3<--------------------0,3
=>y=0,3
ta có CO2 + Ca(OH)2 -->CaCO3 +H2O
0,2<-------------------- 0,2
=> x=0,2 mol
tỉ lệ về số mol cũng là tỉ lệ thể tích
%VCO=(0,2/0,5).100%=40% , %VH2=60%.
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn 1,82 gam hỗn hợp C4H10, C3H4, C2H2, dẫn toàn bộ sản phẩm vào bình 1 đựng P2O5 dư, bình 2 đựng dung dịch Ca(OH)2 dư. Sau khi phản ứng xong thấy khối lượng bình 1 tăng 2,34 gam, bình 2 có m gam kết tủa. Tìm m.
Giúp em bài này với ạ!
Khối lượng \(\left(1\right)\) tăng \(H2O\) sinh ra
\(\Rightarrow n_{H_2O}=\dfrac{2,34}{18}=0,13\)
Sơ đồ phản ứng : \(C_xH_y+O_2\rightarrow CO_2+H_2O\)
Bảo toàn các nguyên tố \(C;H\)
\(m_X=m_C+m_H\Rightarrow n_{CO2}=n_C=\dfrac{m_X-m_H}{12}=\dfrac{1,82-0,13.2}{12}=0,13\)
Bài toán cho ta \(0,13\left(mol\right)CO2\) và \(0,1\left(mol\right)Ca\left(OH\right)_2\)
Ta thấy tạo thành 2 muối :
Giai hệ \(\left\{{}\begin{matrix}n_{HCO_3}+n_{CO_3^2}=n_{CO_2}\\n_{HCO_3}+2n_{CO^2_3}=n_{OH}\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}n_{HCO_3}=0,06\\n_{CO^2_3}=0,07\end{matrix}\right.\)
Như vậy sẽ có \(0,07\left(mol\right)CaCO_3\) kết tủa
\(\Rightarrow m\downarrow=0,07.100=7\)
Đúng 2
Bình luận (1)
Đốt cháy hoàn toàn 5,6 lít hỗn hợp khí etilen.
a. Viết PTHH xảy ra.
b. Hãy tính thể tích khí oxi cần dùng ( ở đktc )
c. Nếu cho toàn bộ sản phẩm đi qua dung dịch Ca(OH)2 dư thì sẽ thu được bao nhiêu gam kết tủa
( Mình đang cần gấp )
a, \(C_2H_4+3O_2\underrightarrow{t^o}2CO_2+2H_2O\)
b, \(n_{C_2H_4}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Theo PT: \(n_{O_2}=3n_{C_2H_4}=0,75\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,75.22,4=16,8\left(l\right)\)
c, \(n_{CO_2}=2n_{C_2H_4}=0,5\left(mol\right)\)
PT: \(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3+H_2O\)
Theo PT: \(n_{CaCO_3}=n_{CO_2}=0,5\left(mol\right)\)
\(\Rightarrow m_{CaCO_3}=0,5.100=50\left(g\right)\)
Đúng 1
Bình luận (0)