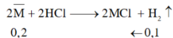hoà tan hoàn tan 5,6g kim loại M trong dd HCl, thu đc 2,24 lít khí H2 ở đktc. Tìm kim loại M

Những câu hỏi liên quan
Hoà tan hoà toàn m gam kim loại M bằng dd HCl dư, thu được muối MCln và V lít H2 (đktc). Mặt khác hoà tan hoàn toàn m gam M bằng dd HNO3 loãng, thu được muối M(NO3)m, H2O và cũng V lít khí NO duy nhất (đktc).
a/ So sánh n và m.
b/ Hỏi M là kim loại nào? Biết rằng khối lượng muối nitrat tạo thành gấp 1,905 lần khối lượng muối clorua.
a)Gọi hóa trị của M trong muối clorua là n
Gọi hóa trị của M trong muối nitrat là m
2M + 2nHCl -----> 2MCln + nH2
_1___________________n/2_
3M + 4mHNO3 -----> 3M(NO3)m + mNO + 2mH2O
_1_________________________m/3_
Ta có: VH2 = VNO => nH2 = nNO
m/3 = n/2 --> n/m = 2/3 => n = 2; m = 3
Vậy hóa trị của M trong muối clorua < hóa trị của M trong muối nitrat
b,
mM(NO3)m = 1,905m.MCln
M + 62m = 1,905x(M + 35,5n)
<=> 0,905M + 67,6275n = 62m
<=> M = (62m - 67,6275n)/0,905
Thay n = 2; m = 3 vào ta được
M = 56 (Fe)
Đúng 0
Bình luận (0)
Hoà tan hoàn toàn 6,75g một kim loại M chưa rõ hoá trị trong dung dịch HCl thì thu được 8,4 lít khí H2 ở đktc. Xác định kim loại M
Đặt kim loại M có hoá trị n (n ∈ N*)
\(n_{H_2}=\dfrac{8,4}{22,4}=0,375\left(mol\right)\)
PTHH: \(2M+2nHCl\rightarrow2MCl_n+nH_2\uparrow\)
\(\dfrac{0,75}{n}\)<------------------------0,375
\(\rightarrow M_M=\dfrac{6,75}{\dfrac{0,75}{n}}=9n\left(g\text{/}mol\right)\)
Vì n là hoá trị của M nên ta có bảng
| n | 1 | 2 | 3 |
| MM | 9 | 18 | 27 |
| Loại | Loại | Al |
Vậy M là kim loại Al
Đúng 1
Bình luận (0)
\(n_{H_2}=\dfrac{8,4}{22,4}=0,375\left(mol\right)\\
pthh:2M+2xHCl\rightarrow2MCl_x+xH_2\)
\(\dfrac{0,75}{x}\) 0,375 (mol)
\(M_M=\dfrac{6,75}{\dfrac{0,75}{x}}=\dfrac{9}{x}\left(\dfrac{g}{mol}\right)\)
xét x = 1 (L)
X = 2 (L)
x= 3 (Al)
=> M là Al có hóa trị III
hoà tan hoàn toàn a gam kim loại Fe trong 250ml dd HCl xM thu được 2,24 lít khí đo ở đktc. a) tìm a,x. b) tính nồng độ phần trăm dd thu được sau phản ứng, biết DddHCl là 1,12g/ml
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1(mol)\\ a,Fe+2HCl\to FeCl_2+H_2\\ \Rightarrow n_{Fe}=0,1(mol);n_{HCl}=0,2(mol)\\ \Rightarrow m_{Fe}=0,1.56=5,6(g)\\ C_{M_{HCl}}=\dfrac{0,2}{0,25}=0,8M\\ b,m_{dd_{HCl}}=250.1,12=280(g)\\ n_{FeCl_2}=0,1(mol)\\ \Rightarrow C\%_{FeCl_2}=\dfrac{0,1.127}{5,6+280-0,1.2}.100\%=4,45\%\)
Đúng 2
Bình luận (0)
Hoà tan hoàn toàn 5,85 gam bột kim loại M vào dung dịch HCl, thu được 7,28 lít khí H 2 đktc. Kim loại M là
A. Mg
B. Al
C. Zn
D. Fe
Cho Mg tác dụng vừa đủ Hcl 7,3% sau phản ứng thu ĐC 2,24 lít khí ở đktc A) tính dd hcl 7,3% cần dùng tính C% các chất. Trong dd sau phản ứng B) lượng axit trên vừa đủ hoà tan x gam oxit kim loại thu ĐC 13,5g muối xác định công thức Oxit kim loại tính x gam
Hoà tan hoàn toàn 3,80 gam hỗn hợp hai kim loại kiềm thuộc hai chu kì liên tiếp trong dung dịch HCl dư, thu được 2,24 lít khí H2 (đktc). Hai kim loại kiềm đó là
A. Li và Na
B. Na và K
C. Rb và Cs
D. K và Rb
Đáp án A
Gọi hai kim loại kiềm là ![]()
2![]() + 2HCl → 2MCl + H2
+ 2HCl → 2MCl + H2
0,2 ← 0,1 (mol)
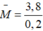 = 19 => 2 kim loại là Li(7) và Na (23)
= 19 => 2 kim loại là Li(7) và Na (23)
Đúng 0
Bình luận (0)
Hoà tan hoàn toàn 3,80 gam hỗn hợp hai kim loại kiềm thuộc hai chu kì liên tiếp trong dung dịch HCl dư, thu được 2,24 lít khí H2 (đktc). Hai kim loại kiềm đó là
A. Li và Na.
B. Na và K
C. Rb và Cs
D. K và Rb
Hoà tan hoàn toàn 3,80 gam hỗn hợp hai kim loại kiềm thuộc hai chu kì liên tiếp trong dung dịch HCl dư, thu được 2,24 lít khí H2 (đktc). Hai kim loại kiềm đó là
A. Li và Na.
B. K và Rb.
C. Rb và Cs.
D. Na và K.
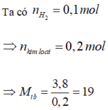
=> có kim loại Li, mà 2 kim loại thuộc 2 chu kỳ liên tiếp nên còn lại là Na
Đáp án là A
Đúng 0
Bình luận (0)
câu 1 : hòa tan hoàn toan 3,9g kim loại X bằng dd HCl thu đc 1,344 lít khí H2 (ĐKTC) .tìm kim loại X ?
Gọi hóa trị của kim loại là a
PTHH: 2X + 2aHCl ===> 2XCla + aH2
nH2 = 1,244 / 22,4 = 0,06 mol
=> nX = \(\frac{0,06.2}{a}=\frac{0,12}{a}\)
=> MX = \(\frac{m}{n}=\frac{3,9.a}{0,12}=32,5a\)
Ta chỉ thấy a = 2 là thỏa mãn
=> MX = 65
=> X là kẽm ( Zn )
Đúng 2
Bình luận (0)
Ta có \(n_{H_2}=\frac{1,344}{22,4}=0,06\left(mol\right) \)
Gọi m là hóa trị của kim loại X \(\left(1\le m\le3\right)\)
PTHH \(2X+2mHCl\rightarrow2XCl_m+mH_2\)
Theo PTHH ta có \(n_X=\frac{2}{m}n_{H_2}=\frac{0,12}{m}\left(mol\right)\)
\(\Rightarrow M_X=\frac{3,9}{\frac{0,12}{m}}=32,5m\)
Với \(m=1\Rightarrow M=32,5\left(loại\right)\)
\(m=2\Rightarrow M=65\left(lấy\right)\) (Zn)
\(m=3\Rightarrow M=97,5\left(loại\right)\)
Đúng 0
Bình luận (0)