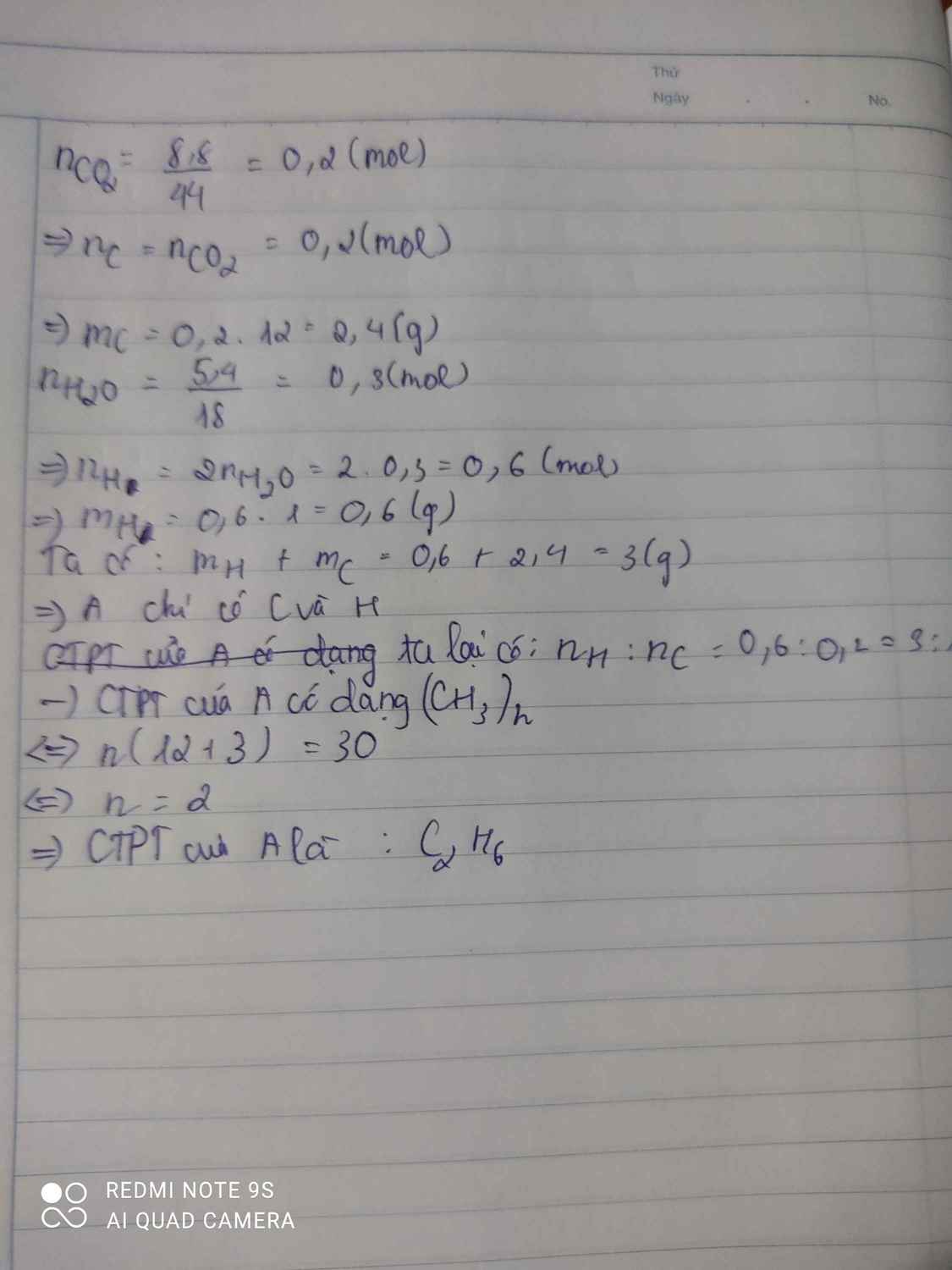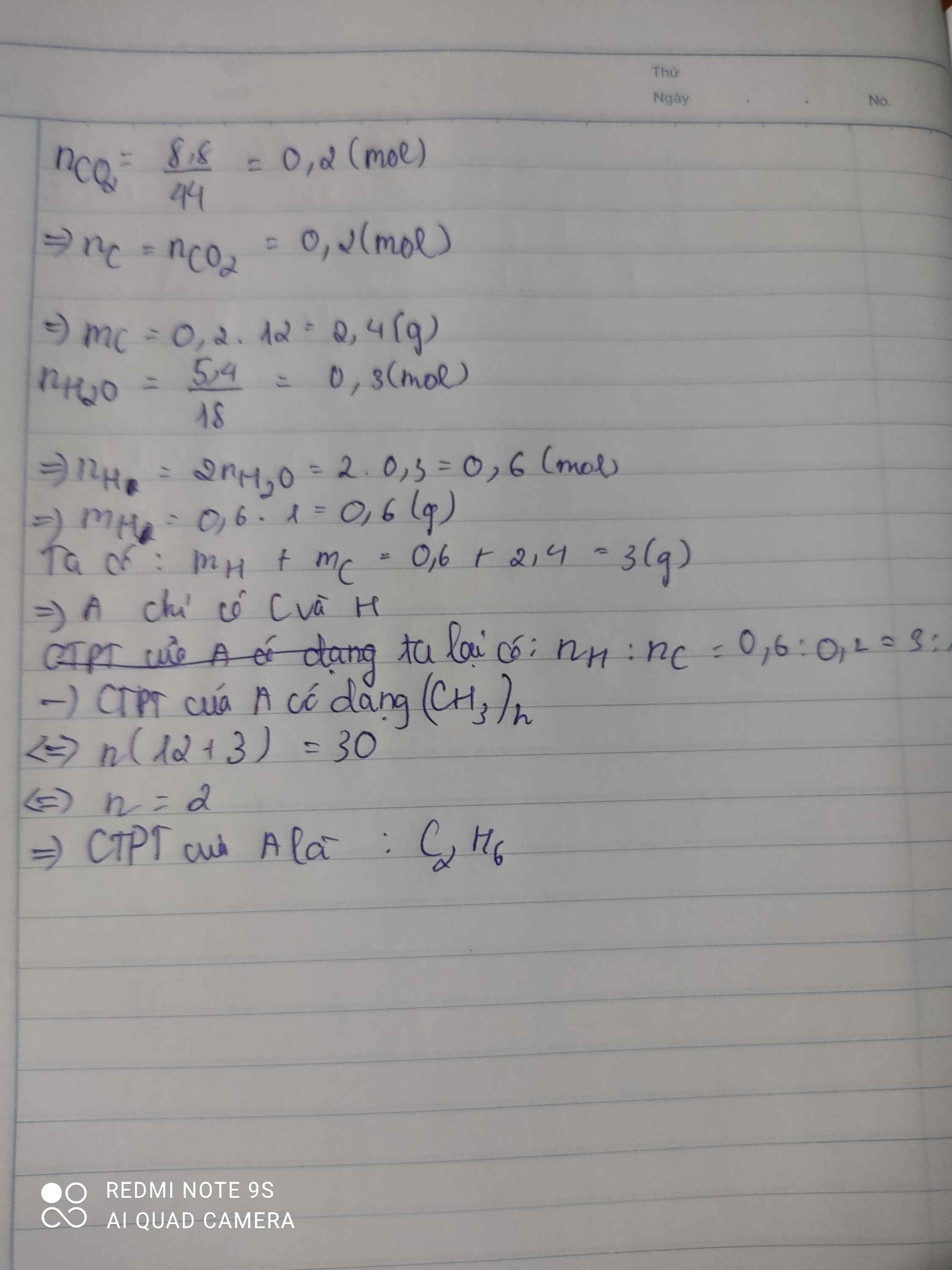Tìm CTPT của hiđrôcacbon A mà sau khi đốt cháy thu được 2,703(g) CO2 và 1,108(g) H2O biết MA < 30

Những câu hỏi liên quan
Tìm công thức phân tử của 1 hiđrocacbon mà sau khi đốt cháy thu được 2,703 gam
C
O
2
và 1,108 gam
H
2
O
? A.
C
2
H
4
B.
C
2
H
6
C.
C
5
H
12
D. ...
Đọc tiếp
Tìm công thức phân tử của 1 hiđrocacbon mà sau khi đốt cháy thu được 2,703 gam C O 2 và 1,108 gam H 2 O ?
A. C 2 H 4
B. C 2 H 6
C. C 5 H 12
D. C 4 H 10
Đặt công thức tổng quát của hiđrocacbon là C x H y .
Ta có:
x : y = n C : n H = m C O 2 44 : m H 2 O 9 = 2,703 44 : 1,108 9 = 0,061 : 0,123 = 1 : 2
⇒ Chọn A.
Đúng 0
Bình luận (0)
1.Đốt cháy 6,4 gam chất hữu cơ A thu được 8,8 g CO2 và 7,2 g H2O. MA = 32. Tìm CTPT A, .Viết CTCT A
nCO2= 0,2 = nC => mC= 2,4g
nH= 2nH2O= 0,8 mol => mH= 0,8g
=> mO= 6,4-2,4-0,8= 3,2g
=> nO= 0,2 mol
nC: nH: nO= 0,2: 0,8: 0,2= 1:4:1
=> CTĐGN (CH4O)n
M= 32 => n=1
Vây CTPT là CH4O
Đúng 3
Bình luận (1)
tk
nCO2= 0,2 = nC => mC= 2,4g
nH= 2nH2O= 0,8 mol => mH= 0,8g
=> mO= 6,4-2,4-0,8= 3,2g
=> nO= 0,2 mol
nC: nH: nO= 0,2: 0,8: 0,2= 1:4:1
=> CTĐGN (CH4O)n
M= 32 => n=1
Vây CTPT là CH4O
Đúng 3
Bình luận (0)
Tìm công thức phân tử của một hiđrocacbon, mà sau khi đốt cháy thu được 2,703 gam CO2 và 1,108 gam H2O.
Ta có
\(n_{CO2}=\frac{2,703}{44}\approx0,06\left(mol\right)\)
\(\Rightarrow n_C=n_{CO2}=0,06\left(mol\right)\)
\(n_{H2O}=\frac{1,108}{18}\approx0,06\)
\(\Rightarrow n_H=2n_{H2O}=0,12\left(mol\right)\)
=>\(n_C:n_H=0,06:0,12=1:2\)
CTĐG: CH2
Gọi CTPT: (CH2)n
Do \(4n< 2n+1\)
=> n =2
=>CTPT:C2H4
Đốt cháy 9g HCHC A thu được 19, 8g CO2 và 10,8 g H2O. Tìm ctpt và ctct biết tỉ khối so với h2 là 30
nC = nCO2 = 19,8/44 = 0,45 (mol)
nH = 2 . nH2O = 2 . 10,8/18 = 1,2 (mol)
nO = (9 - 0,45 . 12 - 1,2)/16 = 0,15 (mol)
CTPT: CxHyOz
=> x : y : z = 0,45 : 1,2 : 0,15 = 3 : 8 : 1
=> (C3H8O)n = 30 . 2 = 60
=> n = 1
CTPT: C3H8O
Đúng 2
Bình luận (0)
MA=30.2=60 (g/mol). nA=9/60=0,15 (mol).
nC(A)=\(n_{CO_2}\)=19,8/44=0,45 (mol) \(\Rightarrow\) A có 3C.
nH(A)=2\(n_{H_2O}\)=2.10,8/18=1,2 (mol) \(\Rightarrow\) A có 8H.
nO(A)=(9-0,45.12-1,2)/16=0,15 (mol) \(\Rightarrow\) A có 1O.
CTPT A là C3H8O. CTCT A: CH3CH2CH2OH hoặc (CH3)2CHOH hoặc CH3CH2OCH3.
Đúng 0
Bình luận (0)
Câu 3:
a, Đốt cháy 5,6 g chất hữu cơ A, thu được 13,2 g CO2 và 3,6 g H2O. Lập CTPT của A biết tỉ khối của A so với khí nitơ bằng 2.
b, Đốt cháy 3 gam chất hữu cơ A, thu được 8,8 gam CO2 và 5,4 gam H2O. Tìm công thức phân tử của A.Biết tỉ khối hơi của A so với H2 bằng 15
1, Bảo toàn khối lượng: mO2 = mCO2 + mH2O – mA = 11,2 g
=> nO2 = 11,2 /32 = 0,35 mol
nCO2 = 0,3 mol, nH2O = 0,2 mol
Bảo toàn nguyên tố: nC(A) = nC(CO2) = nCO2 =0,3 mol
nH(A) = nH(H2O) = 2nH2O =0,4 mol
nO(A) = nO(H2O) + nO(CO2) – nO(O2)= 0,3.2+0,2 -0,35.2= 0,1 mol
Gọi CTPT của A là CxHyOz
=> x : y : z = nC(A) : nH(A) : nO(A) = 3 : 4 : 1
=> CT tối giản của A là C3H4O => CTPT A có dạng (C3H4O)n
MA = 14.2.2=56 => n = 1
Vậy CTPT của A là C3H4O
Đúng 2
Bình luận (0)
b/ n CO2 = 8,8 : 44 = 0,2 mol => m c = 0,2 x 12 = 2,4( g)
n H2O = 5,4 : 18 = 0,3 mol => mH = 0,3 x 2 = 0,6 (g)
Khối lượng của C và H trong A là : 2,4 + 0,6 = 3 (g)
A chỉ chứa hai nguyên tố là C và H
b/ Công thức của A là CxHy ta có:
x ; y = ( mc ; 12) : ( mH : 1) = ( 2,4 : 12) : ( 0,6 : 1) = 1 : 3
Công thức phân tử của A có dạng ( CH3) n . Vì MA =15.2
=> 15 n =30
Nếu n = 1 không đảm bảo hoá trị C
Nếu n = 2 Công thức phân tử của A là C2H6
Đúng 1
Bình luận (0)
a, nC = 13,2/44 = 0,3 (mol)
nH = 2 . 3,6/18 = 0,4 (mol)
nO = (5,6 - 12 . 0,3 - 0,4)/16 = 0,1 (mol)
CTPT: CxHyOz
=> x : y : z = 0,3 : 0,4 : 0,1 = 3 : 4 : 1
=> (C3H4O) = 28 . 2 = 56 (g/mol)
=> n = 1
CTPT: C3H4O
b, nC = 8,8/44 = 0,2 (mol)
nH = 2 . 5,4/18 = 0,6 (mol)
Xét mC + mH = 0,2 . 12 + 0,6 = 3
=> A chỉ có C và H
CTPT: CxHy
=> x : y = 0,2 : 0,6 = 1 : 3
=> (CH3)n = 15 . 2 = 30 (g/mol)
=> n = 2
CTPT: C2H6
Đúng 2
Bình luận (0)
Đốt cháy 3 gam hợp chất hữu cơ B thu được 8,8 gam CO2 và 5,4 gam H2O . Biết phân tử khối của B là 30 g / mol . Tìm CTPT của B
Đốt cháy 3 gam hợp chất hữu cơ B thu được 8,8 gam CO2 và 5,4 gam H2O . Biết phân tử khối của B là 30 g / mol . Tìm CTPT của B
Gọi CTHH của B là \(C_xH_y\)
\(n_B=\dfrac{m_B}{M_B}=\dfrac{3}{30}=0,1mol\)
\(n_C=n_{CO_2}=\dfrac{8,8}{44}=0,2mol\)
\(n_H=2n_{H_2O}=2\cdot\dfrac{5,4}{18}=0,6mol\)
Số nguyên tử cacbon:
\(\overline{C}=\dfrac{n_C}{n_B}=\dfrac{0,2}{0,1}=2\)
Số nguyên tử hidro:
\(\overline{H}=\dfrac{n_H}{n_B}=\dfrac{0,6}{0,1}=6\)
Vậy CTPT của B là \(C_2H_6\)
Đúng 3
Bình luận (0)
2.Đốt cháy hết 11,2 lít khí A đktc thu được 11,2 lít CO2 đktc và 9 g H2O Tìm CTPT,CTCT A biết 1 lít A đktc nặng 1,34 g
nCO2 = V/22.4 = 11.2/22.4 = 0.5 (mol)
===> mCO2 = n.M = 0.5 x 44 = 22 (g)
==> mC = 22 x 12 / 44 = 6 (g)
nH2O = m/M = 9/18 = 0.5 (mol)
==> mH = n.M = 0.5 x 2 = 1 (g)
nA = V/22.4 = 11.2 / 22.4 = 0.5 (mol)
1 lít khí A nặng 1.34 (g)
==> 11.2 lít khí A nặng 1.34x11.2 = 15.008 (g)
A = m/n = 15.008/0.5 = 30.016 xấp xỉ 30
Ta có: mO = mA - (mC + mH) = 8 (g)
CT: CxHyOz
12x/6 = y/1 = 16z/8 = 30/15
==> x = 1; y = 2; z = 1
CT: CH2O
Đúng 3
Bình luận (0)
Đốt cháy hoàn toàn 1,5 g hợp chất hữu cơ A thu được 4,4 g CO2 và 2,7 g H2O. Xác định CTPT của A, biết A nặng hơn khí Heli 7,5 lần
\(M_A=7,5.4=30\left(\dfrac{g}{mol}\right)\\ Hợp.chất.hữu.cơ.A:n_C=n_{CO_2}=\dfrac{4,4}{44}=0,1\left(mol\right)\\ n_{H_2O}=\dfrac{2,7}{18}=0,15\left(mol\right)\Rightarrow n_H=2.0,15=0,3\left(mol\right)\\ m_C+m_H=0,1.12+0,3.1=1,5\left(g\right)\\ \Rightarrow A:không.có.oxi\\ Đặt.A:C_aH_b\left(a,b:nguyên,dương\right)\\ a:b=n_C:n_H=0,1:0,3=1:3\\ \Rightarrow CTTQ:\left(CH_3\right)_n\\ M_{\left(CH_3\right)_n}=30\\ \Leftrightarrow15n=30\\ \Leftrightarrow n=2\\ \Rightarrow A:C_2H_6\)
Đúng 4
Bình luận (0)