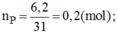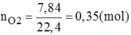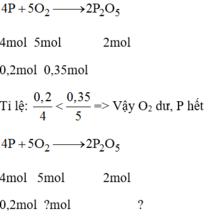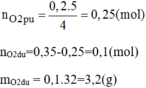Đốt cháy 24g than trong bình chứa 11,2l Oxi(đktc). Hỏi sau phản ứng chất nào còn thừa khối lượng bao nhiêu? Tính thể tich CO2 sinh ra ở đktc

Những câu hỏi liên quan
Bài 2. Đốt cháy 34,8 gam butan C4H10 trong bình chứa 89,6 lít khí oxi (đktc). Phản ứng xảy ra theo sơ đồ sau:
C4H10 + O2 -----> CO2 + H2O
a) Chất nào còn dư sau phản ứng? Khối lượng bằng bao nhiêu gam?.
b) Tính thể tích khí CO2 (đktc) và khối lượng H2O tạo thành sau phản ứng
đốt cháy 2,3gam natri trong bình chứa 0,896 lít oxi(đktc).
a) Sau phản ứng chất nào còn thừa và thừa bao nhiêu gam?
b) Tính khối lượng sản phẩm tạo thành( theo 2 cách).
\(a,n_{Na}=\dfrac{2,3}{23}=0,1\left(mol\right);n_{O_2}=\dfrac{0,896}{22,4}=0,04\left(mol\right)\\ a,PTHH:4Na+O_2\rightarrow2Na_2O\\ Vì:\dfrac{0,1}{4}< \dfrac{0,04}{1}\Rightarrow O_2dư\\ n_{O_2\left(dư\right)}=0,04-\dfrac{0,1}{4}=0,015\left(mol\right)\\ \Rightarrow m_{O_2\left(dư\right)}=0,015.32=0,48\left(g\right)\\ b,C1:n_{Na_2O}=\dfrac{2}{4}.n_{Na}=\dfrac{2}{4}.0,1=0,05\left(mol\right)\\ \Rightarrow m_{Na_2O}=0,05.62=3,1\left(g\right)\\ C2:ĐLBTKL:m_{Na_2O}=m_{Na}+m_{O_2\left(bđ\right)}-m_{O_2\left(dư\right)}=2,3+0,04.32-0,48=3,1\left(g\right)\)
Đúng 2
Bình luận (0)
a. \(n_{Na}=\dfrac{2,3}{23}=0,1\left(mol\right)\)
\(n_{O_2}=\dfrac{0,896}{22,4}=0,04\left(mol\right)\)
PTHH : 4Na + O2 -to> 2Na2O
0,1 0,025 0,05
Xét tỉ lệ : \(\dfrac{0,1}{4}< \dfrac{0,04}{1}\) => Na đủ , O2 dư
\(m_{O_2\left(dư\right)}=\left(0,04-0,025\right).32=0,48\left(g\right)\)
b. Cách 1 : \(m_{Na_2O}=0,05.62=3,1\left(g\right)\)
Cách 2 : \(m_{Na}=0,1.23=2,3\left(g\right)\)
\(m_{O_2}=0,025.32=0,8\left(g\right)\)
Theo ĐLBTKL:
\(m_{Na}+m_{O_2}=m_{Na_2O}\\ \Rightarrow2,3+0,8=3,1\left(g\right)\)
Đúng 1
Bình luận (0)
a,pthh: \(4Na+O_2\underrightarrow{t^o}2Na_2O\)
\(nNa=\dfrac{2,3}{23}=0,1\left(mol\right)\)
\(nO_2=0,896:22,4=0,04\left(mol\right)\)
Xét tỉ lệ : \(\dfrac{nNa}{4}< \dfrac{nO_2}{1}\) ( \(\dfrac{0,1}{4}< \dfrac{0,04}{1}\)) => Oxi dư
\(\Rightarrow nO_{2\left(dư\right)}=0,04-0,025=0,015\left(mol\right)\)
\(nO_{2\left(dư\right)}=0,015.32=0,48\left(g\right)\)
b, do oxi dư nên lấy số mol của natri làm chuẩn.
\(nNa_2O=0,05\left(mol\right)\)
\(mNa_2O=0,05.\left(23.2+16\right)=3,1\left(gam\right)\)
c2: \(mO_{2\left(đủ\right)}=\) 0,8(gam)
BTKL : mNa+mO2=mNa2O
<=> 2,3+ 0,8= mNa2O
=>mNa2O= 3,1 (gam)
Đúng 1
Bình luận (3)
đốt cháy 1kg than trong khí o2, biết than có 10% tạp chất không cháy tính:
- thể tích oxi(đktc) cần thiết để đốt cháy 1kg than trên
-khối lượng co2(đktc) sinh ra trong phản ứng trên
Cnguyên chất = (100%-10%).1000 = 900 (g)
\(n_C=\dfrac{900}{12}=75\left(mol\right)\)
PTHH: C + O2 ---to→ CO2
Mol: 75 75
\(V_{O_2}=75.22,4=1680\left(l\right)\)
\(m_{CO_2}=75.44=3300\left(g\right)\)
Đúng 2
Bình luận (0)
bài 1: đốt cháy 3,92 (lít) ch4 (đktc) trong bình chứa 3,84 (gam) oxi. sản phẩm tạo thành là co2 và h2o. a) viết pthh xảy ra b) sau phản ứng, chất nào còn dư ? khối lượng dư là bao nhiêu gam ? c) cho thể tích khí co2 thu được ở trên vào dd naoh thì thu được h2o và chất tan na2co3. tính khối lượng na2co3?
$a) CH_4 + 2O_2 \xrightarrow{t^o} CO_2 + 2H_2O$
b) $n_{CH_4} = \dfrac{3,92}{22,4} = 0,175(mol)$
$n_{O_2} = \dfrac{3,84}{32} = 0,12(mol)$
Ta thấy : $n_{CH_4} : 1 > n_{O_2} : 2$ nên $CH_4$ dư
$n_{CH_4\ pư} = \dfrac{1}{2}n_{O_2} = 0,06(mol)$
$\Rightarrow m_{CH_4\ dư} = (0,175 - 0,06).16 = 1,84(gam)$
c) $2NaOH + CO_2 \to Na_2CO_3 + H_2O$
Theo PTHH :
$n_{Na_2CO_3} = n_{CO_2} = \dfrac{1}{2}n_{CH_4} = 0,06(mol)$
$m_{Na_2CO_3} = 0,06.106 = 6,36(gam)$
Đúng 1
Bình luận (0)
Đốt cháy 12,4g photpho trong bình kín chứa 67,2 lít ( đktc) gam oxi sau phản ứng hoàn toàn được P2O5
a) Trong hai chất tham gia phản ứng chất nào dư? Giải thích?
b) Sau phản ứng trong bình còn chất nào khối lượng bao nhiêu?
a. \(n_P=\dfrac{12.4}{31}=0,4\left(mol\right)\)
\(n_{O_2}=\dfrac{67.2}{22,4}=3\left(mol\right)\)
Ta thấy : 0,4 < 3 => P đủ , O2 dư
PTHH : 4P + 5O2 -----to-----> 2P2O5
0,4 0,5 0,2
b. \(m_{P_2O_5}=0,2.142=28,4\left(g\right)\)
Đúng 2
Bình luận (5)
Đốt cháy 6,2 gam photpho trong bình chứa 6,72 lít khí oxi (đktc) tạo thành điphotpho pentaoxit.
a) Chất nào còn dư sau phản ứng, với khối lượng là bao nhiêu?
b) Tính khối lượng sản phẩm tạo thành.
nP = 6.2/31 = 0.2 (mol)
nO2 = 6.72/22.4 = 0.3 (mol)
4P + 5O2 -to-> 2P2O5
0.2___0.25_____0.1
mO2 dư = ( 0.3 - 0.25) * 32 = 1.6(g)
mP2O5 = 0.1*142 = 14.2 (g)
Đúng 8
Bình luận (2)
Ta có: \(n_P=\dfrac{6.2}{31}=0.29mol\)
\(n_{O_2}=\dfrac{6.72}{22.4}=0.3mol\)
PTHH:
\(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
ta có:
\(\left\{{}\begin{matrix}\dfrac{n_{P\left(bra\right)}}{nP_{\left(pthh\right)}}=\dfrac{0.2}{4}=0.05\\\dfrac{n_{O_2\left(bra\right)}}{n_{O_2}\left(pthh\right)}=\dfrac{0.3}{5}=0.06\end{matrix}\right.\)
=> \(O_2\) dư
\(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
4 ----------->2
0.2---------->0.1=nP2O5
=>\(m_{P_2O_5}=142.0.1=14.2\left(g\right)\)
Đúng 2
Bình luận (1)
Đốt cháy 12,4g phot-pho ( P ) trong bình chứa 13,44 lít khí oxi ( đktc ) . sau phản ứng , chất nào còn dư . khối lượng P2O5 thu được là bao nhiêu
a) $n_P = \dfrac{12,4}{31} = 0,4(mol) ; n_{O_2} = \dfrac{13,44}{22,4} = 0,6(mol)$
$4P + 5O_2 \xrightarrow{t^o} 2P_2O_5$
Ta thấy :
$n_P : 4 < n_{O_2} : 5$ nên $O_2$ dư
Điphotpho pentaoxit được tạo thành
$n_{P_2O_5} = \dfrac{1}{2}n_P = 0,2(mol)$
$m_{P_2O_5} = 0,2.142 = 28,4(gam)$
Đúng 1
Bình luận (0)
Đốt cháy 6,2g photpho trong bình chứa 7,84 lit oxi (đktc). Hãy cho biết sau khi cháy: Photpho hay oxi, chất nào còn thừa và khối lượng là bao nhiêu?
Đốt cháy hoàn toàn 6,2 gam photpho trong bình chứa 8,96 lít khí oxi (ở đktc) thu được điphotpho pentaoxit (P2O5).
(a) Sau phản ứng chất nào còn dư và dư bao nhiêu mol?
(b)Tính khối lượng P2O5 thu được.
(c) Nếu hiệu suất phản ứng là 80% thì khối lượng P2O5 thu được là bao nhiêu?
giúp e với ạ , e cảm ơn
\(n_P=\dfrac{6,2}{31}=0,2\left(mol\right)\\ n_{O_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\\ PTHH:4P+5O_2\underrightarrow{t^o}2P_2O_5\\ LTL:\dfrac{0,2}{4}< \dfrac{0,4}{5}\Rightarrow O_2dư\)
\(n_{O_2\left(pư\right)}=\dfrac{5}{4}n_P=\dfrac{5}{4}.0,2=0,25\left(mol\right)\\ n_{O_2\left(dư\right)}=0,4-0,25=0,15\left(mol\right)\)
\(n_{P_2O_5\left(lt\right)}=\dfrac{1}{2}n_P=\dfrac{1}{2}.0,2=0,1\left(mol\right)\\ m_{P_2O_5\left(lt\right)}=0,1.142=14,2\left(g\right)\\ m_{P_2O_5\left(tt\right)}=0,1.142.80\%=11,36\left(g\right)\)
Đúng 6
Bình luận (0)