Cho 1 gam bột Fe tiếp xúc với oxi một thời gian thu được 1,24 gam hỗn hợp Fe2O3 và Fe dư. Tính lượng Fe dư.

Những câu hỏi liên quan
Bài 2 : Cho 1 (g) bột Fe phản ứng với Oxi , một thời gian thu được 1,24 (g) hỗn hợp Fe2O3 và Fe dư. Tính khối lượng Fe dư.
Bài 2 : Cho 1 (g) bột Fe phản ứng với Oxi , một thời gian thu được 1,24 (g) hỗn hợp Fe2O3 và Fe dư.
Tính khối lượng Fe dư.
#
Cho 4,72 gam hỗn hợp bột gồm các chất Fe, FeO và Fe2O3 tác dụng với CO ở nhiệt độ cao. Phản ứng xong thu được 3,92 gam Fe. Nếu ngâm cùng lượng hỗn hợp các chất trên trong dung dịch CuSO4 dư, phản ứng xong khối lượng chất rắn thu được là 4,96 gam. Khối lượng (gam) Fe, Fe2O3 và FeO trong hỗn hợp ban đầu lần lượt là A. 1,68; 1,44; 1,6 B. 1,6; 1,54; 1,64 C. 1,6; 1,44; 1,64 D. 1,68; 1,6; 1,44
Đọc tiếp
Cho 4,72 gam hỗn hợp bột gồm các chất Fe, FeO và Fe2O3 tác dụng với CO ở nhiệt độ cao. Phản ứng xong thu được 3,92 gam Fe. Nếu ngâm cùng lượng hỗn hợp các chất trên trong dung dịch CuSO4 dư, phản ứng xong khối lượng chất rắn thu được là 4,96 gam. Khối lượng (gam) Fe, Fe2O3 và FeO trong hỗn hợp ban đầu lần lượt là
A. 1,68; 1,44; 1,6
B. 1,6; 1,54; 1,64
C. 1,6; 1,44; 1,64
D. 1,68; 1,6; 1,44
Đáp án D
Các phản ứng xảy ra:
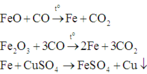
Hỗn hợp rắn thu được khi cho hỗn hợp phản ứng với dung dịch CuSO4 gồm Cu, FeO và Fe2O3.
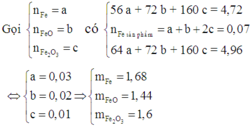
Đúng 0
Bình luận (0)
Để m gam bột sắt ngoài không khí, sau một thời gian sẽ chuyển thành hỗn hợp A có khối lượng 37,6 gam gồm Fe, FeO, Fe2O3, Fe3O4. Cho hỗn hợp A phản ứng hết với H2SO4 đặc, nóng, dư thu được 3,36 lít khí SO2 (đktc). Giá trị của m là A. 56,0. B. 28,0 C. 11,2. D. 8,4.
Đọc tiếp
Để m gam bột sắt ngoài không khí, sau một thời gian sẽ chuyển thành hỗn hợp A có khối lượng 37,6 gam gồm Fe, FeO, Fe2O3, Fe3O4. Cho hỗn hợp A phản ứng hết với H2SO4 đặc, nóng, dư thu được 3,36 lít khí SO2 (đktc). Giá trị của m là
A. 56,0.
B. 28,0
C. 11,2.
D. 8,4.
Đáp án B
Xét giai đoạn A tác dụng với H2SO4 đặc, nóng, dư:
Số mol SO2 thu được là: n SO 2 = 0 , 15 mol
Qui đổi hỗn hợp A thành Fe : a mol; O : b mol
![]()
Sơ đồ phản ứng :
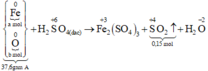
Các quá trình nhường, nhận electron:
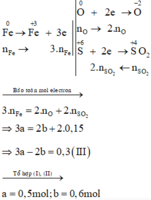
Xét giai đoạn để m gam Fe ngoài không khí:
Sơ đồ phản ứng :

Đúng 1
Bình luận (0)
Nung nóng 12,6 gam Fe ngoài không khí sau một thời gian thu được m gam hỗn hợp X gồm Fe, FeO, Fe2O3 và Fe3O4 . Hỗn hợp này phản ứng hết với dung dịch H2SO4 đặc nóng (dư), thu được 4,2 lít khí SO2 (sản phẩm khử duy nhất, ở đktc). Tính m? A. 15g B. 9g C.18g D. 24g
Đọc tiếp
Nung nóng 12,6 gam Fe ngoài không khí sau một thời gian thu được m gam hỗn hợp X gồm Fe, FeO, Fe2O3 và Fe3O4 . Hỗn hợp này phản ứng hết với dung dịch H2SO4 đặc nóng (dư), thu được 4,2 lít khí SO2 (sản phẩm khử duy nhất, ở đktc). Tính m?
A. 15g
B. 9g
C.18g
D. 24g
Đáp án A
Ta có, nFe = 0,225 mol và nSO2 = 0,1875 mol
Quy hỗn hỗn hợp X về 2 nguyên tố Fe và O
Quá trình nhường: Fe0 → Fe+3 + 3e
Quá trình nhận e: O0 + 2e → O-2
S+6 + 2e → S+4
Áp dụng định luật bảo toàn electron ta có:
0,675 = 2x + 0,375 → x = 0,15
Mặt khác ta có: nên: m = 12,6 + 0,15.16 = 15 (gam).
Đúng 1
Bình luận (0)
Nung nóng hỗn hợp gồm 5,6 gam Fe với 4 gam bột S trong bình kín một thời gian thu được hỗn hợp X gồm FeS, FeS2, Fe và S dư. Cho X tan hết trong dung dịch H2SO4 đặc nóng dư được V lít khí (đktc). Giá trị của V là ? A. 8,96 B. 11,65 C. 3,36 D. 11,76
Đọc tiếp
Nung nóng hỗn hợp gồm 5,6 gam Fe với 4 gam bột S trong bình kín một thời gian thu được hỗn hợp X gồm FeS, FeS2, Fe và S dư. Cho X tan hết trong dung dịch H2SO4 đặc nóng dư được V lít khí (đktc). Giá trị của V là ?
A. 8,96
B. 11,65
C. 3,36
D. 11,76
Trộn 16,8 gam bột Fe với 6,4 gam bột S thu được hỗn hợp X.Nung nóng X một thời gian thu được hỗn hợp rắn Y. Cho Y tác dụng với dung dịc H2SO4 loãng dư thu được V lít(đktc) hỗn hợp khí Z có tỉ khối đối với H2 bằng 9.
a, Tìm giá trị V?
b,Tính hiệu suất phản ứng giữa Fe và S?
H2S:xmol;H2:ymol
ppe:x+y=0.3
nhh=x+y=0.3=>V=6.72l
34x+2y=18*(x+y)
x=0.15;y=0.15
FeS-->H2S
0.15 0.15
Fe+S-->FeS(1)
0.3 0.2 0.2
(1)=>nFeS lt=0.2
H=nFeS tt/nFeS lt *100=75%
Đúng 0
Bình luận (0)
H2S:xmol;H2:ymol
ppe:x+y=0.3
nhh=x+y=0.3=>V=6.72l
34x+2y=18*(x+y)
x=0.15;y=0.15
FeS-->H2S
0.15 0.15
Fe+S-->FeS(1)
0.3 0.2 0.2
(1)=>nFeS lt=0.2
H=nFeS tt/nFeS lt *100=75%
Đúng 0
Bình luận (0)
Bài 3. Cho 17,6 gam hỗn hợp Fe và Cu phản ứng với lượng dư dung dịch HCl loãng, sau phản ứng thu được 4,48 lít khí (đktc) a. Tính %m mỗi chất trong hỗn hợp ban đầu. b. Dẫn khí H2 thu được ở trên đi qua bột Fe2O3 nung nóng, tính khối lượng Fe tối đa có thể thu được
a) Ta có: nH2=4,48/22,4=0,2(mol)
PTHH: Fe +2 HCl -> FeCl2 + H2
0,2________0,4______0,2__0,2(mol)
mFe=0,2.56=11,2(g)
=> %mFe= (11,2/17,6).100=63,636%
=> %mCu= 36,364%
b) Fe2O3 + 3 H2 -to-> 2 Fe + 3 H2O
Ta có: nH2=0,2(mol) => nFe=2/3. 0,2= 2/15(mol)
=> mFe= 2/15 . 56=7,467(g)
Đúng 1
Bình luận (0)
Số moll của khí hidro ở dktc
nH2 = \(\dfrac{V_{H2}}{22,4}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Pt : Fe + 2HCl → FeCl2 + H2\(|\)
1 2 1 1
0,2 0,2
a) Số mol của sắt
nFe = \(\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
Khối lượng của sắt
mFe = nFe . MFe
= 0,2. 56
= 11,2 (g)
Khối lượng của đồng
mCu = 17,6 - 11,2
= 6,4 (g)
0/0Fe = \(\dfrac{m_{Fe}.100}{m_{hh}}=\dfrac{11,2.100}{17,6}=63,64\)0/0
0/0Cu = \(\dfrac{m_C.100}{m_{hh}}=\dfrac{6,4.100}{17,6}=36,36\)0/0
b) 3H2 + Fe2O3 → (to) 2Fe + 3H2O\(|\)
3 1 2 3
0,2 0,13
Số mol của sắt
nFe = \(\dfrac{0,2.2}{3}=0,13\left(mol\right)\)
Khối lượng của sắt
mFe = nFe . MFe
= 0,13 . 56
= 7,28 (g)
Chúc bạn học tốt
Đúng 1
Bình luận (0)
Oxi hoá chậm m gam Fe ngoài không khí thu được 12g hỗn hợp A gồm FeO, Fe2O3, Fe3O4 và Fe dư. Hoà tan hỗn hợp A vừa đủ bởi dung dịch HNO3 thu được 2,24 lít NO duy nhất (đktc). Khối lượng m gam Fe ban đầu là:
sử dụng phương pháp bảo toàn electron
‘-Các quá trình cho nhận electron:
Fe0 → Fe3+ + 3e
O20 +4e → 2O2-2
\(\dfrac{m}{56}->\dfrac{3m}{56}\dfrac{12-m}{32}->\dfrac{12-m}{8}\)
=> \(\dfrac{3m}{56}=\dfrac{12-m}{8}\) +0,3 => m = 10,08 (gam)
Đúng 4
Bình luận (0)
Cho a gam bột sắt tác dụng với oxi trong điều kiện thích hợp thu được hỗn hợp B gồm (Fe, FeO, Fe2O3 , Fe3O4 ) có khối lượng là 21,6 gam. Cho hỗn hợp B tác dụng với dung dịch HNO3 loãng dư sau khi phản ứng kết thúc thu được 2,24 NO là sản phẩm khử duy nhất .Tính a
Quy đổi hỗn hợp B gồm Fe (x mol) và O (y mol)
Ta có: \(56x+16y=21,6\) (1)
Bảo toàn electron: \(3x=2y+3n_{NO}=2y+0,3\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,3\\y=0,3\end{matrix}\right.\) \(\Rightarrow m_{Fe}=0,3\cdot56=16,8\left(g\right)\)
Đúng 1
Bình luận (2)



















