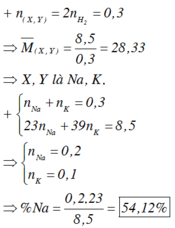hòa tan hoàn toàn 10,1g hỗn hợp 2 kl kiềm ở 2 chu kì liên tiếp vaof nước, thu được 3,36l H2 (đktc) . phần trăm theo kl của mỗi kl trong hỗn hợp là

Những câu hỏi liên quan
Hòa tan hoàn toàn 8,5 gam hỗn hợp gồm 2 kim loại kiềm X, Y (ở hai chu kì liên tiếp, MX MY) vào nước, thu được 3,36 lít H2 (đktc). Phần trăm khối lượng của X trong hỗn hợp ban đầu là A. 54,12%. B. 45,89%. C. 27,05%. D. 72,95%.
Đọc tiếp
Hòa tan hoàn toàn 8,5 gam hỗn hợp gồm 2 kim loại kiềm X, Y (ở hai chu kì liên tiếp, MX < MY) vào nước, thu được 3,36 lít H2 (đktc). Phần trăm khối lượng của X trong hỗn hợp ban đầu là
A. 54,12%.
B. 45,89%.
C. 27,05%.
D. 72,95%.
Hòa tan hoàn toàn 8,5 gam hỗn hợp gồm 2 kim loại kiềm X, Y (ở hai chu kì liên tiếp, MX MY) vào nước, thu được 3,36 lít H2 (đktc). Phần trăm khối lượng của X trong hỗn hợp ban đầu là A. 72,95% B. 54,12% C. 27,05% D. 45,89%
Đọc tiếp
Hòa tan hoàn toàn 8,5 gam hỗn hợp gồm 2 kim loại kiềm X, Y (ở hai chu kì liên tiếp, MX < MY) vào nước, thu được 3,36 lít H2 (đktc). Phần trăm khối lượng của X trong hỗn hợp ban đầu là
A. 72,95%
B. 54,12%
C. 27,05%
D. 45,89%
Hòa tan hoàn toàn 8,5 gam hỗn hợp gồm 2 kim loại kiềm X, Y (ở hai chu kì liên tiếp, MX My) vào nước thu được 3,36 lít H2 (ở đktc). Phần trăm khối lượng của X trong hỗn hợp ban đầu là A. 54,12%. B. 45,89%. C. 27,05%. D. 72,95%.
Đọc tiếp
Hòa tan hoàn toàn 8,5 gam hỗn hợp gồm 2 kim loại kiềm X, Y (ở hai chu kì liên tiếp, MX < My) vào nước thu được 3,36 lít H2 (ở đktc). Phần trăm khối lượng của X trong hỗn hợp ban đầu là
A. 54,12%.
B. 45,89%.
C. 27,05%.
D. 72,95%.
ĐÁP ÁN A
X + H2O -> XOH + ½ H2
=> nKL = 2nH2 = 0,3 mol
=> Mtb = 28,33 => X là Na : x mol và Y là K : y mol
=> 23x + 39y = 8,5 và x + y = 0,3
=> x = 0,2 ; y = 0,1 mol
=> %mNa(hh) = 54,12%
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn 8,5 gam hỗn hợp gồm 2 kim loại kiềm X, Y (ở hai chu kì liên tiếp, MX MY) vào nước thu được 3,36 lít H2 (ở đktc). Phần trăm khối lượng của X trong hỗn hợp ban đầu là: A. 54,12%. B. 45,89%. C. 27,05%. D. 72,95%.
Đọc tiếp
Hòa tan hoàn toàn 8,5 gam hỗn hợp gồm 2 kim loại kiềm X, Y (ở hai chu kì liên tiếp, MX < MY) vào nước thu được 3,36 lít H2 (ở đktc). Phần trăm khối lượng của X trong hỗn hợp ban đầu là:
A. 54,12%.
B. 45,89%.
C. 27,05%.
D. 72,95%.
Hòa tan hết 11,6gam hỗn hợp X gồm 2 KL ( nhóm IA thuộc hai chu kì liên tiếp ) vào 108,8 gam nước, sau phản ứng thu được dung dịch Y và 4,48 lít H2 (đktc)
a) Xác định tên 2 kim loại trong hỗn hợp X
b) Tính % KL mỗi kim loại trong hỗn hợp X
c) Tính C% của chất tan có trong dung dịch Y
a)
Gọi CTTQ của hai kim loại nhóm IA là R
\(n_{H_2} = \dfrac{4,48}{22,4} = 0,2(mol)\\ 2R + 2H_2O \to 2ROH + H_2\)
Theo PTHH :
\(n_R = 2n_{H_2} = 0,4(mol)\\ \Rightarrow R = \dfrac{11,6}{0,4} = 29(g/mol)\)
Ta thấy : \(M_{Na} = 23 < 29 < M_{K} = 39\)
Vậy hai kim loại cần tìm là Natri,Kali
b)
Gọi \(n_{Na} = a(mol) ; n_K = b(mol)\)
Ta có :
\(23a + 39n = 11,6\\ a + b = 0,4\)
Suy ra : a = 0,25 ; b = 0,15
Vậy :
\(\%m_{Na} = \dfrac{0,25.23}{11,6}.100\% = 49,57\%\\ \%m_{K} = 100\% - 49,57\% = 50,43\%\)
c)
Sau phản ứng,mdung dịch = 11,6 + 108,8 - 0,2.2 = 120(gam)
\(n_{NaOH} = n_{Na} = 0,25\ mol\\ n_{KOH} = n_K = 0,15\ mol\)
Suy ra :
\(C\%_{NaOH} = \dfrac{0,25.40}{120}.100\% = 8,33\%\\ C\%_{KOH} = \dfrac{0,15.56}{120}.100\% = 7\%\)
Đúng 1
Bình luận (0)
Cho 3,1 g hỗn hợp gồm hai kim loại kiềm ở hai chu kì kế tiếp nhau trong bảng tuần hoàn tác dụng hết với nước thu được 1,12 lít H2 ở đktc và dung dịch kiềm. Xác định tên 2 KL đó và tính thành phần phần trăm khối lượng mỗi kim loại
Gọi công thức chung cho hai kim loại kiềm là M
Số mol H2: nH2 = 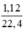 = 0,05(mol)
= 0,05(mol)
PTHH: 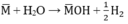
Theo pt: nM = 2. nH2 = 2. 0,05 = 0,1(mol)
⇒ M = 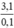 = 31 → Na, K
= 31 → Na, K
Gọi x, y lần lượt là số mol của Na và K trong hỗn hợp
Theo bài ra ta có hệ phương trình:
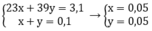
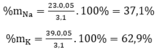
Đúng 1
Bình luận (0)
Hòa tan hoàn toàn 8,5 gam hỗn hợp gồm 2 kim loại kiềm X, Y (ở 2 chu kì kế tiếp, MX<MY) vào nước thu được 3,36 lít khí H2 (ở đktc). Phần trăm khối lượng của X trong hỗn hợp ban đầu là
A. 72,95%.
B. 54,12%.
C. 27,05%.
D. 45,89%.
Giải thích:
nH2 = 3,36/ 22,4 = 0,15 (mol)
Gọi công thức chung của 2 kim loại kiềm là M
2M + 2H2O → 2MOH + H2↑
0,3 ← 0,15 (mol)
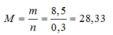
=> Mx < 28,33 < MY và X, Y là 2 kim loại kiềm kế tiếp => X là kim loại Na, Y là kim loại K
Na: x ( mol) ; K: y (mol)
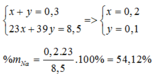
Đáp án B
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn 20,02 gam hỗn hợp 2 kim loại kiềm A,B (2 chu kì liên tiếp) vào lượng nước dư. Sau phản ứng xảy ra ht thu được 8,96L H2. xác định tên 2 KL
\(n_{H2}=\frac{8,96}{22,4}=0,4\left(mol\right)\)
Đặt CTTB của hai kim loại kiềm là \(\overline{R}\)
PTHH : \(2\overline{R}+2H_2O-->2\overline{R}OH+H_2\uparrow\)
Theo pthh : \(n_{\overline{R}}=2n_{H2}=0,8\left(mol\right)\)
=> \(M_{\overline{R}}=\frac{20,02}{0,8}=25,025\) (g/mol)
Mà hai kim loại kiềm ở hai chu kì liên tiếp => \(\hept{\begin{cases}Natri:23\left(Na\right)\\Kali:39\left(K\right)\end{cases}}\)
Cho 8,5 gam hỗn hợp kim loại kiềm ở hai chu kỳ kế nhau vào nước thu được 3,36l khí hidro (đktc).
a) XĐ mỗi KL kiềm.
b) Tính khối lượng mỗi KL trong hỗn hợp
- Vì hỗn hợp 2 kim loại kiềm ở 2 chu kì kế nhau lên hỗn hợp kim loại kim loại đó sẽ gồm 2 kim loại : Na, K .
PTHH ( I ) : \(2Na+2H_2O\rightarrow2NaOH+H_2\)
........................x...........x...................x..........\(\frac{1}{2}\)x...........
PTHH ( II ) : \(2K+2H_2O\rightarrow2KOH+H_2\)
.......................y...........y..................y..........\(\frac{1}{2}\)y............
- Gọi số mol của Na, K trong hỗn hợp lần lượt là x, y ( x, y > 0 )
Ta có : \(m_{hh}=m_{Na}+m_K=n_{Na}.M_{Na}+n_K.M_K=8,5\)
=> \(23x+39y=8,5\) ( I )
\(n_{H_2}=\frac{V_{H_2}}{22,4}=\frac{3,36}{22,4}=0,15\left(mol\right)\)
Mà \(n_{H_2}=n_{H_2\left(I\right)}+n_{H_2\left(II\right)}\)
=> \(0,5x+0,5y=0,15\left(II\right)\)
- Từ ( I ) và ( II ) ta có hệ phương trình : \(\left\{{}\begin{matrix}23x+39y=8,5\\0,5x+0,5y=0,15\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}23\left(0,3-y\right)+39y=8,5\\x=0,3-y\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}6,9-23y+39y=8,5\\x=0,3-y\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}y=0,1\\x=0,3-0,1=0,2\end{matrix}\right.\) ( TM )
=> \(\left\{{}\begin{matrix}n_{Na}=0,2\left(mol\right)\\n_K=0,1\left(mol\right)\end{matrix}\right.\)
-> \(m_{Na}=n.M=0,2.23=4,6\left(g\right)\)
Mà \(m_{hh}=m_{Na}+m_K=8,5\)
=> \(m_K=m_{hh}-m_{Na}=8,5-4,6=3,9\left(g\right)\)