Cho 1 dây Mg khối lượng 30g vào 200g dung dịch FeSO4 7,6% đến p/ư hoàn toàn . Sau p/ư lấy dây Mg ra rửa sạch làm khô. Tính KL dây Mg sau pư biết toàn bộ kim loại giải phóng ra bám vào dây Mg
PLZ!!!
hép mi
ngâm 3,6g thanh Mg vào 240g dd CuSO4 16% sau một thời gian pứ, lấy kim loại Mg ra khỏi dd, rửa nhẹ, làm khô thì cân nặng 7,6g (giả thiết toàn bộ lượng kim loại tạo thành bám hết vào thanh kim loại và lượng nước trong dd thay đổi không đáng kể)
Viết PTHH và tính nồng độ phần trăm của các chất trong dd sau pứ.
Gọi số mol CuSO4 pư là a (mol)
\(n_{CuSO_4\left(bđ\right)}=\dfrac{240.16\%}{160}=0,24\left(mol\right)\)
PTHH: Mg + CuSO4 --> MgSO4 + Cu
a<------a--------->a------->a
=> mthanh kim loại sau pư = 3,6 - 24a + 64a = 7,6
=> a = 0,1 (mol)
Trong dd sau pư chứa \(\left\{{}\begin{matrix}MgSO_4:0,1\left(mol\right)\\CuSO_4:0,24-0,1=0,14\left(mol\right)\end{matrix}\right.\)
mdd sau pư = 240 + 24.0,1 - 64.0,1 = 236 (g)
\(\left\{{}\begin{matrix}C\%_{MgSO_4}=\dfrac{0,1.120}{236}.100\%=5,085\%\\C\%_{CuSO_4}=\dfrac{0,14.160}{236}.100\%=9,49\%\end{matrix}\right.\)
Nhúng thanh kim loại Mg có khối lượng m gam vào dung dịch chứa 0,2 mol CuSO4, sau một thời gian lấy thanh kim loại ra, thấy khối lượng CuSO4đã tham gia phản ứng là 80%. Thanh kim loại sau khi lấy ra đem đốt cháy trong O2dư, thu được (m + 12,8) gam chất rắn (cho rằng Cu giải phóng bám hết vào thanh Mg). Khối lượng thanh kim loại sau khi lấy ra khỏi dung dịch CuSO4 là
A. 10,24 gam
B. 12,00 gam
C. 16,00 gam
D. 9,60 gam

Số mol: 0,16......0,16.............................0,16
Sau phản ứng với dung dịch CuSO4 khối lượng thanh kim loại là
![]()
Thanh kim loại sau khi lấy ra có x mol Mg dư và 0,16 mol Cu
Khi đốt trong oxi dư:
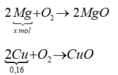
mO2 = (m + 12,8) – (m + 6,4) = 6,4 → nO2 = 0,2 mol
0,5 x + 0,08 = 0,2 → x = 0,24 mol
Khối lượng thanh kim loại sau khi lấy ra khỏi dung dịch CuSO4 là
0,24 . 24 + 0,16 . 64 = 16 gam
Đáp án C
Nhúng thanh kim loại Mg có khối lượng m gam vào dung dịch chứa 0,2 mol CuSO4, sau một thời gian lấy thanh kim loại ra, thấy khối lượng CuSO4đã tham gia phản ứng là 80%. Thanh kim loại sau khi lấy ra đem đốt cháy trong O2dư, thu được (m + 12,8) gam chất rắn (cho rằng Cu giải phóng bám hết vào thanh Mg). Khối lượng thanh kim loại sau khi lấy ra khỏi dung dịch CuSO4 là
A. 10,24 gam
B. 12,00 gam
C. 16,00 gam
D. 9,60 gam
Nhúng thanh kim loại Mg có khối lượng m gam vào dung dịch chứa 0,2 mol C u S O 4 , sau một thời gian lấy thanh kim loại ra, thấy khối lượng C u S O 4 đã tham gia phản ứng là 80%. Thanh kim loại sau khi lấy ra đem đốt cháy trong O 2 dư, thu được (m + 12,8) gam chất rắn (cho rằng Cu giải phóng bám hết vào thanh Mg). Khối lượng thanh kim loại sau khi lấy ra khỏi dung dịch C u S O 4 là
A. 12,00 gam
B. 16,00 gam
C. 9,60 gam
D. 10,24 gam
Chọn đáp án B
n C u S O 4 p ư = 0 , 2 . 80 100 = 0 , 16 m o l
PTHH: M g + C u S O 4 → M g S O 4 + C u
Số mol: 0,16…0,16……..0,16
Sau phản ứng với dung dịch C u S o 4 khối lượng thanh kim loại là:
m 1 =m-24.0,16+64.0,16=m+6,4 (g)
Thanh kim loại sau khi lấy ra có x mol Mg dư và 0,16 mol Cu
Khi đốt trong oxi dư:
2 M g ⏟ x m o l + O 2 → 2 M g O
2 C u ⏟ 0 , 16 + O 2 → C u O
m O 2 (m + 12,8) – ( m + 6,4) = 6,4 → n O 2 =0,2 mol
0,5x + 0,08 = 0,2 x = 0,24 mol
Khối lượng thanh kim loại sau khi lấy ra khỏi dung dịch C u S O 4 là
0,24 . 24+ 0,16 . 64 = 16 gam
Hòa tan hỗn hợp X gồm Cu và Fe2O3 trong 400 ml dung dịch HCl a (M) thu được dung dịch Y và còn lại 1,0 gam Cu không tan. Nhúng thanh Mg vào dung dịch Y, sau khi phản ứng hoàn toàn nhấc thanh Mg ra thấy khối lượng tăng thêm 4,0 gam so với khối lượng thanh Mg ban đầu và có 1,12 lít khí H2 (đo ở đktc) thoát ra (giả thiết toàn bộ lượng kim loại thoát ra đều bám hết vào thanh Mg). Khối lượng Cu va a?
Vì còn Cu nên chứng tỏ Fe+3 đã bị chuyển hết thành Fe+2 rồi.
gọi x là số mol Cu+2 và 2x là số mol Fe+2
Ta dùng phương pháp tăng giảm KL
64x + 56.2x - 24.3x = m tăng
m tăng = 4 + 0,05.24 ( một phần bị axit hòa tan ) suy ra x = 0,05
Vậy khối lượng Cu ban đầu là
1 + 0,05 .64 = 4,2 g
Số Mol axit bằng
3x.2 + 2.nH2 = 0,4 mol
Ngâm một lá Fe có khối lượng 100 gam trong 200 ml dung dịch CuSO4 0,5M một thời gian lấy lá Fe ra rửa sạch, sấy khô cân lại thấy nặng 100,4 gam. Giả sử toàn bộ kim loại sinh ra đều bám vào thanh sắt. Khối lượng FeSO4 có trong dung dịch sau phản ứng là
A. 3,2 gam
B. 6,4 gam
C. 7,6 gam
D. 14,2 gam
Đáp án C
Ta cớ pứ: Fe + Cu2+ → Fe2+ + Cu.
Đặt nFepứ = a ⇒ nCu = a.
⇒ mCu – mFe pứ = 0,4 Û 8a = 0,8 Û a = 0,05.
⇒ mFeSO4 = 0,05×152 = 7,6 gam
Ngâm một lá Fe có khối lượng 100 gam trong 200 ml dung dịch CuSO4 0,5M một thời gian lấy lá Fe ra rửa sạch, sấy khô cân lại thấy nặng 100,4 gam. Giả sử toàn bộ kim loại sinh ra đều bám vào thanh sắt. Khối lượng FeSO4 có trong dung dịch sau phản ứng là
![]()
![]()
![]()
![]()
Ngâm một lá Fe có khối lượng 100 gam trong 200 ml dung dịch CuSO4 0,5M một thời gian lấy lá Fe rửa sạch, sấy khô cân lại thấy nặng 100,4 gam, Giả sử toàn bộ kim loại sinh ra đều bám vào sắt. Khối lượng FeSO4 có trong dung dịch sau phản ứng là:
A. 3,2 gam .
B. 6,4 gam.
C. 7,6 gam
D. 14,2 gam.
Đáp án C
nCuSO4 = 0,2. 0,5 = 0,1 (mol) ; Gọi nFe phản ứng = x (mol)
PTHH: Fe + CuSO4 → FeSO4 + Cu ↓
Theo PTHH 56x 64x
Khối lượng kim loại tăng ∆ = (64x -56x)= 8x (g)
Theo đề bài ∆m tăng = ( 100,4 -100) = 0,4 (g)
=> 8x = 0,4
=> x = 0,05 (mol)
=> mFeSO4 = 0,05. 152 = 7,6 (g)
Trong số các thí nghiệm sau, có mấy thí nghiệm chỉ xảy ra sự ăn mòn hóa học?
(1) Đốt cháy dây sắt trong không khí khô.
(2) Cho hợp kim Fe – Cu vào dung dịch CuSO4.
(3) Đốt dây kim loại Mg nguyên chất trong khí Cl2.
(4) Cho Fe vào dung dịch AgNO3.
A. 2.
B. 3.
C. 4.
D. 1.
Chọn đáp án A.
(1) Đốt cháy dây sắt trong không khí khô.
(3) Đốt dây kim loại Mg nguyên chất trong khí Cl2.