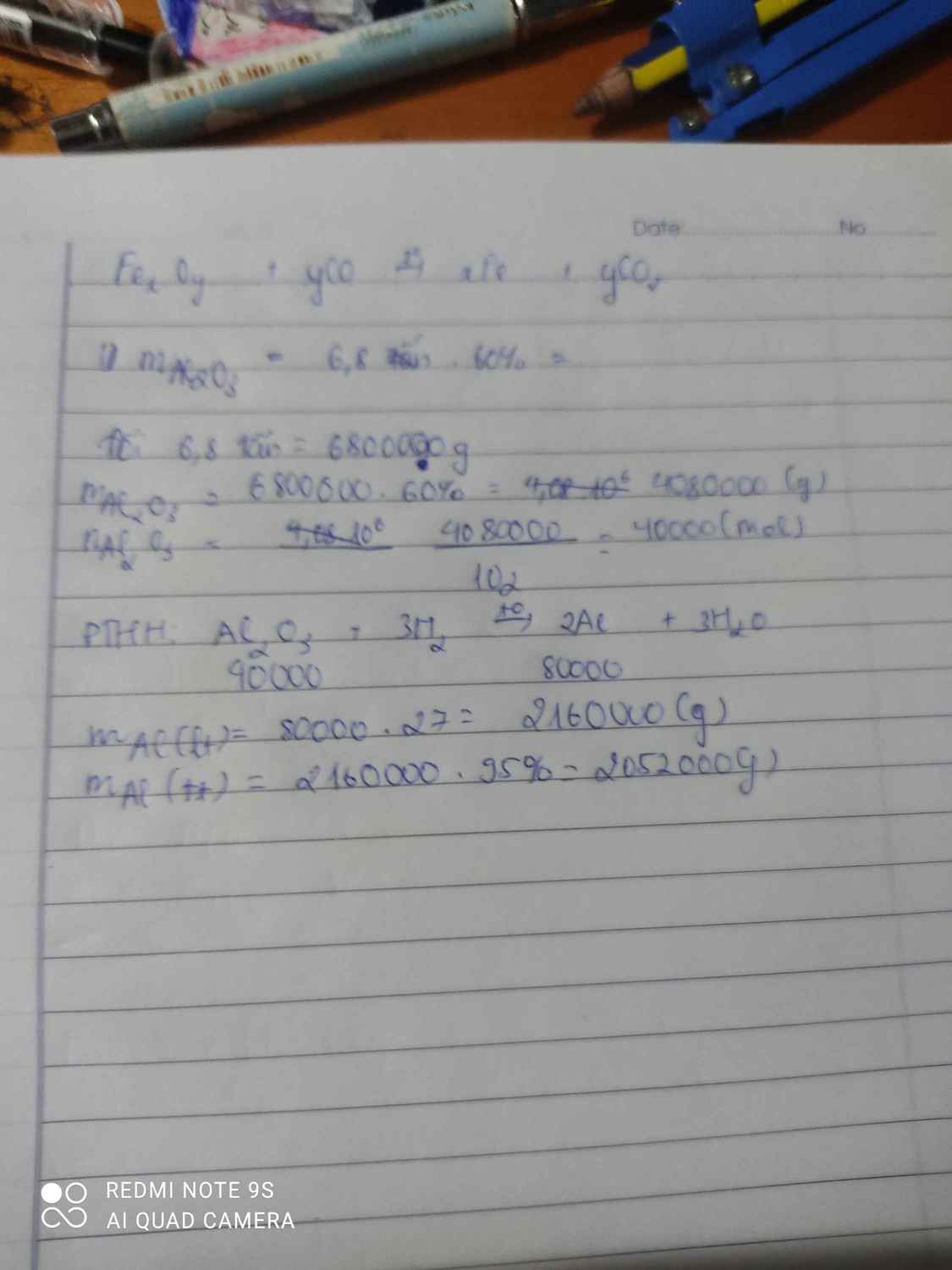Một loại quặng boxit chứa 60% Al2O3. Sản xuất Al từ 2,125 tấn quặng boxit đó bằng phương pháp điện phân nóng chảy Al2O3 thu được 0,54 tấn Al. Tính hiệu suất quá trình sản xuất Al.

Những câu hỏi liên quan
Người ta dùng quặng boxit để sản xuất Al. Hàm lượng Al 2 O 3 trong quặng là 40%. Để có được 4 tấn nhôm nguyên chất cần bao nhiêu tấn quặng ? Biết rằng hiệu suất của quá trình sản xuất là 90%.
Thực tế do một số nguyên nhân, chất tham gia phản ứng không tác dụng hết, nghĩa là hiệu suất dưới 100%. Người ta có thể tính hiệu suất phản ứng như sau :
1. Dựa vào một trong các chất tham gia phản ứng, công thức tính :

2.Dựa vào một trong các chất tạo thành, công thức tính :
2 Al 2 O 3 → 4Al + 3 O 2
Dựa vào phương trình ta có: Cứ 204g Al 2 O 3 thì tạo ra 108g Al
⇒ Để tạo ra 4 tấn Al thì khối lượng Al 2 O 3 cần = 4.204/108 = 7,55g
Hiệu suất phản ứng là 90%, có nghĩa là 7,55 tấn Al 2 O 3 chỉ chiếm 90% khối lượng phải dùng.
Khối lượng oxit phải dùng : 7,55x100/90 = 8,39 tấn
Khối lượng quặng boxit: 8,39x100/40 = 20,972 tấn
Đúng 2
Bình luận (0)
1 loại quặng boxit có chứa 60% tạp chất AL2O3. AL luyện từ oxit đó có chứa % tạp chất. tính khối lượng AL thu được khi luyện 6,8 tấn quặng trên. Biết hiệu suất =95%
Giải hộ mình vớiiiiiii
chứa % tạp chất vậy đó là bao nhiêu phần trăm em ơi?
Đúng 1
Bình luận (0)
Từ 1 tấn quặng boxit ( có chứa 81,6% Al2O3 còn lại là tạp chất ko chứa Al hỏi người ta sản xuất được bao nhiêu tấn Al
Đổi 1 tấn boxit = 1000kg
+mAl2O3 = 1000*81,6%= 816kg = 816000g
Để sản xuất Al người ta cần khử O2 từ Al2O3 bằng H2
-> nAl2O3 = 816000/102=8000mol
PT : Al2O3 + 3H2 --t-> 2Al + 3H2O
theo PT : nAl = 2nAl2O3 = 16000 mol
-> mAl thu được = 16000 * 27 = 432000g = 432 tấn
Đúng 0
Bình luận (0)
người ta dùng quặng boxit để sản xuất al. hàm lượng al2o3 trong quặng là 40%. để có được 4 tấn nhôm nguyên chất thì cần bao nhiêu tấn quặng?
tính khối lượng Al sản suất được từ 1,5 tấn quặng boxit chứa 90% Al2O3 biết hiệu suất quá trình phản ứng là 90%
mAl2O3=1,35 tấn
2Al2O3=> 4Al+ 3O2
204 ............108
1,35............x
=> x=0,71 tấn
mAl thu được= 90%*0,71=0,639 tấn=639 kg
Đúng 0
Bình luận (0)
Quặng boxit có thành phần chính là Al2O3.Điện phân nóng chảy 40kg quặng oxit thu được 16,2kg Al và 14,4kg O2
a. Lập PTHH
a.Xác định tỉ lệ phần trăm của Al2O3 có trong quặng boxit
\(a,PTHH:2Al_2O_3\xrightarrow{đpnc}4Al+3O_2\\ b,BTKL:m_{Al_2O_3}=m_{Al}+m_{O_2}=30,6(kg)\\ \Rightarrow \%_{Al_2O_3}=\dfrac{30,6}{40}.100\%=76,5\%\)
Đúng 1
Bình luận (0)
Điện phân nóng cháy m (kg) quặng boxit ( chứa 60% Al2O3) thu được 5,4 kg nhôm và 4,8 kg oxi. Tính a (biết phản ứng Al2O3 ->Al+O2)
Bảo toàn khối lượng :
$m_{Al_2O_3} = m_{Al} + m_{O_2} = 5,4 + 4,8 = 10,2(kg)$
$m_{quặng\ boxit} = \dfrac{m_{Al_2O_3}}{60\%} = \dfrac{10,2}{60\%} = 17(kg)$
Đúng 2
Bình luận (0)
Một loại quặng boxit chứa 48,5% Al2O3. Từ 1 tấn quặng boxit nói trên có thể điều chế được bao nhiêu kilogam nhôm? (Biết hiệu suất của của quá trình điều chế là 90%)
Xem chi tiết
\(m_{Al_2O_3}=1\cdot48,5:100=0,485\left(tấn\right)\\\Rightarrow\dfrac{0,485}{102}=\dfrac{m_{Al\left(100\%\right)}}{27}\\ \Rightarrow m_{Al\left(100\%\right)}=0,128\left(tấn\right)\\ m_{Al\left(90\%\right)}=0,128\cdot90:100=0,1155\left(tấn\right)\)
Đúng 2
Bình luận (1)
Bài 2. Nhôm oxit (Al2O3) là thành phần chính của quặng boxit, còn lại là tạp chất . điện phân nóng chảy 127,5 gam quặng boxit theo phản ứng :Al2O3 Al + O2.Thu được 54 gam Al (nhôm) và 48 gam O2 (khí oxi) a.Tính khối lượng Al2O3 (Nhôm oxit) đã phản ứng? b.Tính tỉ lệ phần trăm về khối lượng của Nhôm oxit có trong quặng boxit?
Đọc tiếp
Bài 2. Nhôm oxit (Al2O3) là thành phần chính của quặng boxit, còn lại là tạp chất . điện phân nóng chảy 127,5 gam quặng boxit theo phản ứng :
Al2O3 Al + O2.
Thu được 54 gam Al (nhôm) và 48 gam O2 (khí oxi)
a.Tính khối lượng Al2O3 (Nhôm oxit) đã phản ứng?
b.Tính tỉ lệ phần trăm về khối lượng của Nhôm oxit có trong quặng boxit?
a/ nAl= 54/27= 2(mol)
nO2=48/32=1,5(mol)
PTHH: 2 Al2O3 -to-> 4 Al +3 O2
Ta có: 2/4 = 1,5/3
=> P.ứ hết
=> nAl2O3= 1/2. nAl=1/2. 2=1(mol)
=> mAl2O3=1.102=102(g)
b) %mAl2O3= (102/127,5).100= 80%
Đúng 2
Bình luận (0)