hòa tan oàn toàn 6,94 g hỗn hợp gồm FexOy vào Al vào 100ml dd axit sunfuric loãng 1,5 M , sau phản ứng thu được0,672 L KHÍ h2 .xÁC ĐỊNH CÔNG THỨC HÓA HỌC feXoY

Những câu hỏi liên quan
Cho m2 gam hỗn hợp gồm Al và FexOy, nung nóng hỗn hợp để thực hiện phản ứng nhiệt nhôm (chỉ xảy ra phản ứng tạo thành Fe và nhôm oxit). Hỗn hợp sau phản ứng được chia làm 2 phần, phần 1 có khối lượng là 9,39 gam. Hòa tan hoàn toàn phần 1 bằng axit HCl dư thì thu được 2,352 lít khí (đktc). Phần 2 tác dụng vừa đủ với 900ml dung dịch NaOH 0,2M thấy giải phóng 0,672 lít khí (đktc). Xác định công thức hóa học của FexOy, tính giá trị m2 (biết các phản ứng xảy ra hoàn toàn).
Đọc tiếp
Cho m2 gam hỗn hợp gồm Al và FexOy, nung nóng hỗn hợp để thực hiện phản ứng nhiệt nhôm (chỉ xảy ra phản ứng tạo thành Fe và nhôm oxit). Hỗn hợp sau phản ứng được chia làm 2 phần, phần 1 có khối lượng là 9,39 gam. Hòa tan hoàn toàn phần 1 bằng axit HCl dư thì thu được 2,352 lít khí (đktc). Phần 2 tác dụng vừa đủ với 900ml dung dịch NaOH 0,2M thấy giải phóng 0,672 lít khí (đktc). Xác định công thức hóa học của FexOy, tính giá trị m2 (biết các phản ứng xảy ra hoàn toàn).
Phần 2:
nH2 = 0,03 => nAl dư = 0,02
nNaOH = nAl dư + 2nAl2O3 => nAl2O3 = 0,08
Phần 1:
nAl dư = 0,02k; nAl2O3 = 0,08k; nFe = a
=> 0,02k.27 + 0,08k.102 + 56a = 9.39
nH2 = 0.02k.1,5 + a = 0,105
k = 0.5 và a = 0,09
Fe : O = a : (0,08k.3) => Fe3O4
m2 = 9,39 + 9,39/k =28,17g
Đúng 0
Bình luận (0)
Tiến hành phản ứng nhiệt nhôm hỗn hợp gồm Al và FexOy trong khí trơ đến khi phản ứng xảy ra hoàn toàn thu được hỗn hợp rắn X. Chia hỗn hợp X thành hai phần bằng nhau. Phần 1 cho vào dung dịch NaOH loãng dư, thấy lượng NaOH phản ứng là 8,0 gam, đồng thời thoát ra 1,344 lít khí H2 (đktc). Phần 2 tác dụng hết với dung dịch HCl loãng dư, thu được 5,376 lít khí H2 (đktc). Công thức FexOy là: A. FeO. B. Fe3O4. C. Fe2O3. D. Fe2O3 hoặc Fe3O4.
Đọc tiếp
Tiến hành phản ứng nhiệt nhôm hỗn hợp gồm Al và FexOy trong khí trơ đến khi phản ứng xảy ra hoàn toàn thu được hỗn hợp rắn X. Chia hỗn hợp X thành hai phần bằng nhau. Phần 1 cho vào dung dịch NaOH loãng dư, thấy lượng NaOH phản ứng là 8,0 gam, đồng thời thoát ra 1,344 lít khí H2 (đktc). Phần 2 tác dụng hết với dung dịch HCl loãng dư, thu được 5,376 lít khí H2 (đktc). Công thức FexOy là:
A. FeO.
B. Fe3O4.
C. Fe2O3.
D. Fe2O3 hoặc Fe3O4.
b) Xác định công thức phân tử của X, biết tỉ khối của X đối với H2 bằng 16.Câu 6: Hòa tan hoàn toàn 11 gam hỗn hợp X gồm Al và Fe bằng dung dịch axit sunfuric loãng dư. Sau khi phản ứng kết thúc thu được 8,96 lít khí (đktc) a) Tính thành phần % về khối lượng mỗi kim loại trong hỗn hợp X? b) Tính khối lượng muối khan thu được? c) Lượng khí Hiđro ở trên khử vừa đủ 23,2 gam oxit của kim loại M. Xác định công thức hóa học của oxit đó?Câu 7: Hòa tan hết 4,8 gam hỗn hợp A gồm MgO, Fe2O3, CuO cần vừ...
Đọc tiếp
b) Xác định công thức phân tử của X, biết tỉ khối của X đối với H2 bằng 16.
Câu 6: Hòa tan hoàn toàn 11 gam hỗn hợp X gồm Al và Fe bằng dung dịch axit sunfuric loãng dư. Sau khi phản ứng kết thúc thu được 8,96 lít khí (đktc)
a) Tính thành phần % về khối lượng mỗi kim loại trong hỗn hợp X?
b) Tính khối lượng muối khan thu được?
c) Lượng khí Hiđro ở trên khử vừa đủ 23,2 gam oxit của kim loại M. Xác định công thức hóa học của oxit đó?
Câu 7: Hòa tan hết 4,8 gam hỗn hợp A gồm MgO, Fe2O3, CuO cần vừa đủ một lượng dung dịch chứa 5,84 gam HCl. Mặt khác, dẫn khí H2 dư qua 0,09 mol hỗn hợp A nung nóng thì sau phản ứng thu được 1,62 gam nước. Tính khối lượng mỗi chất trong 4,8 gam hỗn hợp A.
câu 7
MgO + 2HCl -> MgCl2 + H2O
x 2x
Fe2O3 + 6HCl -> 2FeCl3 + 3H2O
y 6y
CuO + 2HCl -> CuCl2 + H2O
z 2z
A--H2 dư----> MgO + H2O
Fe
Cu
Fe2O3 + 3H2 -> 2Fe + 3H2O
ky
CuO + H2 -> Cu + H2O
kz
nH2O=\(\dfrac{16,2}{18}\)0,09mol
Gọi nMgO=x, nFe2O3=y, nCuO=z (trong 4,8g hh A)
nMgO=kx, nFe2O3=ky, nCuO=kz (trong 0,09mol A)
=> kx+ky+kz =4,8
3ky + kz= 0,09=> 2ky = kx =>\(\left\{{}\begin{matrix}2y=x\\40x+160y+80z=4,8\\2x+6y+2z=\dfrac{5,84}{36,5}=0,16\end{matrix}\right.\)
+ x=0,02
=> mMgO= 0,8g
+y=0,01
=> mFe2O3=1,6g
+ z=0,03
=> mCuO=2,4g
Đúng 1
Bình luận (0)
Gọi x,y lần lượt là số mol của Al, Fe
nH2 = 0,2×2711.100%=49,1%0,2×2711.100%=49,1%
% mFe = 0,4y0,4y<-------0,4
Ta có: ⇔23,2=22,4xy+6,4⇔23,2=22,4xy+6,4
⇔xy=16,822,4=34⇔xy=16,822,4=34
Vậy CTHH của oxit: Fe3O4
Đúng 0
Bình luận (0)
Nung hỗn hợp X gồm Al và FexOy trong khí trơ, thu được 22,88 gam rắn Y gồm Al2O3, Al, Fe và FexOy. Cho toàn bộ Y vào dung dịch NaOH loãng dư, thu được 0,12 mol khí H2 và m gam rắn Z. Hòa tan hết m gam Z trong dung dịch chứa 0,72 mol HNO3, thu được 0,08 mol khí NO (sản phẩm khử duy nhất của N+5) và dung dịch chứa 53,12 gam muối. Công thức của FexOy và khối lượng của Al2O3 trong Y là: A. Fe2O3 và 4,08 gam B. Fe3O4 và 6,12 gam C. Fe3O4 và 4,08 gam D. Fe2O3 và 6,12 gam
Đọc tiếp
Nung hỗn hợp X gồm Al và FexOy trong khí trơ, thu được 22,88 gam rắn Y gồm Al2O3, Al, Fe và FexOy. Cho toàn bộ Y vào dung dịch NaOH loãng dư, thu được 0,12 mol khí H2 và m gam rắn Z. Hòa tan hết m gam Z trong dung dịch chứa 0,72 mol HNO3, thu được 0,08 mol khí NO (sản phẩm khử duy nhất của N+5) và dung dịch chứa 53,12 gam muối. Công thức của FexOy và khối lượng của Al2O3 trong Y là:
A. Fe2O3 và 4,08 gam
B. Fe3O4 và 6,12 gam
C. Fe3O4 và 4,08 gam
D. Fe2O3 và 6,12 gam
Nung hỗn hợp X gồm Al và FexOy trong khí trơ, thu được 22,88 gam rắn Y gồm Al2O3, Al, Fe và FexOy. Cho toàn bộ Y vào dung dịch NaOH loãng dư, thu được 0,12 mol khí H2 và m gam rắn Z. Hòa tan hết m gam Z trong dung dịch chứa 0,72 mol HNO3, thu được 0,08 mol khí NO (sản phẩm khử duy nhất của N+5) và dung dịch chứa 53,12 gam muối. Công thức của FexOy và khối lượng của Al2O3 trong Y là A. Fe2O3 và 6,12 gam B. Fe3O4 và 6,12 gam C. Fe3O4 và 4,08 gam D. Fe2O3 và 4,08 gam
Đọc tiếp
Nung hỗn hợp X gồm Al và FexOy trong khí trơ, thu được 22,88 gam rắn Y gồm Al2O3, Al, Fe và FexOy. Cho toàn bộ Y vào dung dịch NaOH loãng dư, thu được 0,12 mol khí H2 và m gam rắn Z. Hòa tan hết m gam Z trong dung dịch chứa 0,72 mol HNO3, thu được 0,08 mol khí NO (sản phẩm khử duy nhất của N+5) và dung dịch chứa 53,12 gam muối. Công thức của FexOy và khối lượng của Al2O3 trong Y là
A. Fe2O3 và 6,12 gam
B. Fe3O4 và 6,12 gam
C. Fe3O4 và 4,08 gam
D. Fe2O3 và 4,08 gam
Đáp án C
Cho Y tác dụng với NaOH loãng dư thu được 0,12mol H2 do vậy Y chứa 0,08 mol Al.
Rắn Z thu được gồm Fe và FexOy.
Hòa tan hết Z trong 0,72 mol HNO3 thu được 0,08 mol NO và 53,12 gam muối.
Bảo toàn N: n N O 3 - t r o n g m u o i = 0 , 72 - 0 , 08 = 0 , 64 m o l
Bảo toàn e:
n O t r o n g Z = 0 , 64 - 0 , 08 . 3 2 = 0 , 2 m o l → m = 0 , 2 . 16 + 0 , 24 . 56 = 16 , 64 g a m
Trong Y: m A l 2 O 3 = 22 , 88 - 16 , 64 - 0 , 08 . 27 = 4 , 08
→ n A l 2 O 3 = 0 , 04 m o l
Bảo toàn O: n O t r o n g Z = 0 , 2 + 0 , 04 . 3 = 0 , 32
Vậy: x : y = 0,24 : 0,32 = 3:4 nên oxi là Fe3O4.
Đúng 0
Bình luận (0)
Nung hỗn hợp X gồm Al và FexOy trong khí trơ, thu được 22,88 gam rắn Y gồm Al2O3, Al, Fe và FexOy. Cho toàn bộ Y vào dung dịch NaOH loãng dư, thu được 0,12 mol khí H2 và m gam rắn Z. Hòa tan hết m gam Z trong dung dịch chứa 0,72 mol HNO3, thu được 0,08 mol khí NO (sản phẩm khử duy nhất của N+5) và dung dịch chứa 53,12 gam muối. Công thức của FexOy và khối lượng của Al2O3 trong Y là A. Fe2O3 và 6,12 gam. B. Fe3O4 và 6,12 gam. C. Fe3O4 và 4,08 gam. D. Fe2O3 và 4,08 gam.
Đọc tiếp
Nung hỗn hợp X gồm Al và FexOy trong khí trơ, thu được 22,88 gam rắn Y gồm Al2O3, Al, Fe và FexOy. Cho toàn bộ Y vào dung dịch NaOH loãng dư, thu được 0,12 mol khí H2 và m gam rắn Z. Hòa tan hết m gam Z trong dung dịch chứa 0,72 mol HNO3, thu được 0,08 mol khí NO (sản phẩm khử duy nhất của N+5) và dung dịch chứa 53,12 gam muối. Công thức của FexOy và khối lượng của Al2O3 trong Y là
A. Fe2O3 và 6,12 gam.
B. Fe3O4 và 6,12 gam.
C. Fe3O4 và 4,08 gam.
D. Fe2O3 và 4,08 gam.
Đáp án C
Cho Y tác dụng với NaOH loãng dư thu được 0,12mol H2 do vậy Y chứa 0,08 mol Al.
Rắn Z thu được gồm Fe và FexOy.
Hòa tan hết Z trong 0,72 mol HNO3 thu được 0,08 mol NO và 53,12 gam muối.
Bảo toàn N:
![]()
Bảo toàn e:
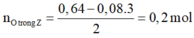
![]()
Trong Y: ![]()
Bảo toàn O:
![]()
Vậy: x : y = 0,24 : 0,32 = 3:4 nên oxi là Fe3O4.
Đúng 0
Bình luận (0)
Sau phản ứng nhiệt nhôm của hỗn hợp X gồm bột Al với
F
e
x
O
y
thu được 9,39 gam chất rắn Y. Cho toàn bộ Y tác dụng với dung dịch NaOH dư thấy có 336 ml khí (đktc) bay ra và phần không tan Z. Để hòa tan 1/3 lượng chất Z cần 12,4 ml dung dịch
H
N
O
3
65,3% (d 1,4 g/ml) và thấy có khí màu nâu đỏ bay ra. Xác định công thức của
F
e
x
O...
Đọc tiếp
Sau phản ứng nhiệt nhôm của hỗn hợp X gồm bột Al với F e x O y thu được 9,39 gam chất rắn Y. Cho toàn bộ Y tác dụng với dung dịch NaOH dư thấy có 336 ml khí (đktc) bay ra và phần không tan Z. Để hòa tan 1/3 lượng chất Z cần 12,4 ml dung dịch H N O 3 65,3% (d = 1,4 g/ml) và thấy có khí màu nâu đỏ bay ra. Xác định công thức của F e x O y .
Hòa tan hoàn toàn 29 g FexOy bằng 800 ml dd HCl 1,5 M . Sau p/ứng ; thu được dd X . Để trung hòa hết lượng axit dư trong X cần 200 ml dung dịch NaOH 1 M . Công thức của FexOy là :
n HCl = 0,8.1,5 = 1,2(mol)
n HCl dư = n NaOH = 0,2.1 = 0,2(mol)
=> n HCl pư = 1,2 - 0,2 = 1(mol)
$2H^+ + O^{2-} \to H_2O$
n O(oxit) = 1/2 n HCl = 0,5(mol)
m Fe + m O = m oxit
=> n Fe = (29 - 0,5.16)/56 = 0,375(mol)
Ta có :
n Fe / n O = 0,375 / 0,5 = 3 / 4 nên oxit là Fe3O4
Đúng 2
Bình luận (0)
cho 6,2 g hỗn hợp X gồm Ca và Na tan hoàn toàn vào nước thu được 3,136 l khí H2 toàn bộ lượng khí H2 này tác dụng vừa đủ với hỗn hợp Y gồm 3,2 g Fe2O3 và a(g) FexOy sau khi phản ứng kết thúc thu được 5,6g Fe a. Tính khối lượng mỗi chất trong X và giá trị của a b. Lập CTHH của FexOy. (thể tích các khí trong bài đo ở đktc)
Ca+ 2H2O -> Ca(OH)2+ H2
nH2= nCa= 0,14 mol
=> mCa= 5,6g
=> mFe= 6,2-5,6= 0,6g
H2 + O -> H2O
=> Y có 0,14 mol O
nFe2O3= 0,02 mol
=> 0,02 mol Fe2O3 có 0,04 mol Fe và 0,06 mol O
Tổng mol Fe sau phản ứng là \(\dfrac{5,6}{56}\)= 0,1 mol
=> FexOy có 0,06 mol Fe và 0,08 mol O
nFe : nO= 0,06 : 0,08= 3 : 4
=> FexOy là Fe3O4
a= 0,06.56+ 0,08.16= 4,64g
Đúng 3
Bình luận (0)
\(n_{H_2}=\dfrac{3,136}{22,4}=0,14mol\)
Gọi \(\left\{{}\begin{matrix}n_{Ca}=x\\n_{Na}=y\end{matrix}\right.\)
\(Ca+2H_2O\rightarrow Ca\left(OH\right)_2+H_2\)
x x ( mol )
\(2Na+2H_2O\rightarrow2NaOH+H_2\)
y 1/2 y ( mol )
Ta có:
\(\left\{{}\begin{matrix}40x+23y=6,2\\x+\dfrac{1}{2}y=0,14\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}x=0,04\\y=0,2mol\end{matrix}\right.\)
\(\rightarrow\left\{{}\begin{matrix}m_{Ca}=0,04.40=1,6g\\m_{Na}=0,2.23=4,6g\end{matrix}\right.\)
\(n_{Fe_2O_3}=\dfrac{3,2}{160}=0,02mol\)
\(Fe_2O_3+3H_2\rightarrow\left(t^o\right)2Fe+3H_2O\)
0,02 0,06 0,04 0,06 ( mol )
\(m_{Fe}=0,04.56=2,24g\)
\(\rightarrow m_{H_2\left(tdFe_xO_y\right)}=0,14-0,06=0,08mol\)
\(n_{Fe\left(tdFe_xO_y\right)}=\dfrac{5,6-0,04.56}{56}=0,06mol\)
\(Fe_xO_y+yH_2\rightarrow\left(t^o\right)xFe+yH_2O\)
0,08 0,06 ( mol )
\(\Rightarrow x:y=0,06:0,08=3:4\)
\(\Rightarrow CTHH:Fe_3O_4\)
Đúng 0
Bình luận (0)























