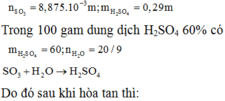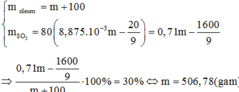tìm khối lượng dung dịch H2SO4 61,25% cần hòa tan 40g SO3 để được dung dịch H2SO4 73,5%

Những câu hỏi liên quan
tìm khối lượng dung dịch H2SO4 61,25% cần hòa tan 40g SO3 để được dung dịch H2SO4 73,5%
\(SO_3\left(0,5\right)+H_2O\left(0,5\right)\rightarrow H_2SO_4\left(0,5\right)\)
Gọi khối lượng dung dịch H2SO4 61,25% là a.
\(\Rightarrow m_{H_2SO_4\left(bđ\right)}=0,6125a\left(g\right)\)
\(n_{SO_3}=\dfrac{40}{80}=0,5\left(mol\right)\)
Khối lượng nước tham gia phản ứng là: \(0,5.18=9\left(g\right)\)
Khối lượng H2SO4 tạo thành thêm là: \(0,5.98=49\left(g\right)\)
Khối lượng của H2SO4 có sau phản ứng là: \(49+0,6125a\left(g\right)\)
Khối lượng dung dịch sau phản ứng là: \(a+40\left(g\right)\)
Theo đề bài ta có:
\(\dfrac{49+0,6125a}{a+40}=0,735\)
\(\Leftrightarrow a=160\left(g\right)\)
Vậy khối lượng dung dịch H2SO4 ban đầu là 160 (g)
Đúng 0
Bình luận (0)
a.Cần hòa tan m (gam) SO3 vào 500 ml dd H2SO4 24,5% (D=1,2g/ml) thu được dd H2SO4 49%.Tìm m?
b. hòa tan 40g SO3 vào m(gam) dd H2SO4 61,25% để thu được dd H2SO4 73,5%.Tìm m?
help me!!! gấp lắm luôn!!
SO3 + H2O --------> H2SO4
m/80...m/80...............m/80 (mol)
mct của dd mới = 500.1,2.0,245 + 49m/40 =147 + 49m/40 (g)
mdd mới = 1,2.500 + m = 600 + m (g)
=> (147 + 49m/40 )/(600 + m) = 0,49
=> m= 200(g)
Đúng 0
Bình luận (0)
2. xác định dung dịch h2so4 61,2% để khi hòa tan vào đó 40g so3 thì thu được dung dịch h2so4 73,5% biết rằng phản ứng xảy ra theo sơ đồ:
so3+h20->h2so4
-Gọi x là số mol H2SO4 61,2%\(\rightarrow m_{dd\left(bđ\right)}=\dfrac{98x.100}{61,2}\left(g\right)\)
\(n_{H_2SO_4\left(tt\right)}=n_{SO_3}=\dfrac{40}{80}=0,5\left(mol\right)\)
\(\rightarrow n_{H_2SO_4\left(sau\right)}=x+0,5\left(mol\right)\)
\(\rightarrow m_{dd\left(sau\right)}=\dfrac{98\left(x+0,5\right).100}{73,5}\left(g\right)\)
Ta có: \(\rightarrow m_{dd\left(sau\right)}=m_{dd\left(bđ\right)}+m_{SO_3}\)
\(\Leftrightarrow\)\(\dfrac{98\left(x+0,5\right).100}{73,5}=\dfrac{98x.100}{61,2}+40\)
Giải ra x\(\approx1\left(mol\right)\)
\(\rightarrow m_{dd\left(bđ\right)}=\dfrac{98.1.100}{61,2}=160,13\left(g\right)\)
Đúng 0
Bình luận (0)
Xác định lượng SO3 và lượng dung dịch H2SO4 49% cần lấy để pha thành 450g dung dịch H2SO4 73,5%
Gọi x là KL SO3 cần lấy và y là KL dd H2SO4 49% cần lấy (g)
mH2SO4(dd 73,5%)= 73,5%. 450=330,75(g) (Axit đặc vậy tạt đánh ghen là chết)
SO3 + H2O -> H2SO4
Ta có hpt:
\(\left\{{}\begin{matrix}x+y=450\\\dfrac{98}{80}x+0,49y=330,75\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=150\\y=300\end{matrix}\right.\)
Vậy cần dùng 150 gam SO3 và 300 gam dung dịch H2SO4 49% để pha chế thành 450 gam dung dịch H2SO4 73,5% (đặc qué rồi)
Đúng 3
Bình luận (2)
Khối lượng oleum chứa 71% SO3 về khối lượng cần lấy để hòa tan vào 100 gam dung dịch H2SO4 60% thì thu được oleum chứa 30% SO3 về khối lượng là: A. 312,56 gam B. 539,68 gam C. 506,78 gam D. 496,68 gam
Đọc tiếp
Khối lượng oleum chứa 71% SO3 về khối lượng cần lấy để hòa tan vào 100 gam dung dịch H2SO4 60% thì thu được oleum chứa 30% SO3 về khối lượng là:
A. 312,56 gam
B. 539,68 gam
C. 506,78 gam
D. 496,68 gam
Khối lượng oleum chứa 71% SO3 về khối lượng cần lấy để hòa tan vào 100 gam dung dịch H2SO4 60% thì thu được oleum chứa 30% SO3 về khối lượng là: A. 312,56 gam B. 539,68 gam C. 506,78 gam D. 496,68 gam
Đọc tiếp
Khối lượng oleum chứa 71% SO3 về khối lượng cần lấy để hòa tan vào 100 gam dung dịch H2SO4 60% thì thu được oleum chứa 30% SO3 về khối lượng là:
A. 312,56 gam
B. 539,68 gam
C. 506,78 gam
D. 496,68 gam
1)Tính khối lượng SO3 cần dùng để khi pha vào 200g dung dịch H2SO4 9,8% thu được dung dịch H2SO4 49%
2)Tính tỉ lệ khối lượng oleum 71% SO3 cần để khi trộn với dung dịch H2SO4 nguyên chất tạo oleum 62%SO3
Câu 1 :
Gọi $n_{SO_3} = a(mol)$
$SO_3 + H_2O \to H_2SO_4$
Sau khi pha :
$m_{dd} = 80a + 200(gam)$
$m_{H_2SO_4} = 98a + 200.9,8\% = 98a + 19,6(gam)$
Suy ra : $C\%_{H_2SO_4} = \dfrac{98a + 19,6}{200 + 80a}.100\% = 49\%$
$\Rightarrow a = 1,333(mol)$
$m_{SO_3} = 1,333.80 = 106,64(gam)$
Đúng 3
Bình luận (0)
Gọi $m_{oleum} = a(gam) ; m_{H_2SO_4} = b(gam)$
Ta có :
Sau khi trộn :
$m_{oleum} = a + b(gam)$
$m_{SO_3} = a.71\% = 0,71a(gam)$
$\Rightarrow \%SO_3 = \dfrac{0,71a}{a + b}.100\% = 62\%$
$\Rightarrow a + b = 0,4402a$
$\Rightarrow \dfrac{a}{b} = \dfrac{1}{1 - 0,4402} = 1,78$
Đúng 1
Bình luận (1)
1.
\(m_{H_2SO_4\left(9.8\%\right)}=200\cdot9.8\%=19.6\left(g\right)\)
\(n_{H_2SO_4}=\dfrac{19.6}{98}=0.2\left(mol\right)\)
\(TC:n_{SO_3}=a\left(mol\right)\)
\(SO_3+H_2O\rightarrow H_2SO_4\)
\(a................a\)
\(m_{H_2SO_4\left(tt\right)}=98a\left(g\right)\)
\(m_{H_2SO_4\left(tổng\right)}=19.6+98a\left(g\right)\)
\(m_{dd_{H_2SO_4}}=200+80a\left(g\right)\)
\(C\%_{H_2SO_4}=\dfrac{19.6+98a}{200+80a}\cdot100\%=49\%\)
\(\Rightarrow a=\dfrac{4}{3}\)
\(m_{SO_3}=\dfrac{4}{3}\cdot80=106.67\left(g\right)\)
Đúng 0
Bình luận (0)
axit H2SO4 100% hấp thụ SO3 tạo ra oleum theo phương trình H2SO4 + SO3 -> H2SO4.nSO3 . Hòa tan 6,76 gam gam oleum vào nước thành 200 ml dung dịch H2SO4 . 10 ml dung dịch trung hòa vừa hết 16 ml dung dịch NaOH 0,5 M a- tính n b- tính hàm lượng % SO3 trong oleum c- cần có bao nhiêu gam oleum có hàm lượng SO3 như trên để pha vào 100 ml dung dịch H2SO4 40% , d= 1,31 g/ml để tạo ra oleum có hàm lượng SO3 là 10%.
H2SO4 + nSO3 => H2SO4.nSO3
H2SO4.nSO3 + nH2O >> n+1H2SO4
H2SO4 + 2NaOH >> Na2SO4 + 2H2O
Số mol NaOH = 0,008 , số mol H2SO4 200ml = 0,008/2 . 200/10 =0,08
Theo (2) nH2SO4.nSO3 =0,08/n+1
MH2SO4.nSO3 =98 +80n = 6,76/0,08/n+1 =84,5n+ 84,5
13,5 =4,5n
=>n=3
%SO3=3.80/2.80+98 =71%
c,Theo câu b , hàm lượng % của SO3 có trong oleum trên là 71
Cứ 100g oleum có 71g SO3 và 29g H2SO4 Khi đó mdd = 1,31.100 = 131g
a g có 71a/100 ...............29a/100
Vì dd H2SO4 có C=40%
Cứ 100g dd có 40g H2SO4 và 60g H2O
=>131g >> 131.40/100 = 52,4g H2SO4 và 131.60/100 = 78,6 g H2O
Khi cho oleum vào dd H2SO4 thì SO3+H2O
SO3 + H2O >> H2SO4
Cứ 80g cần 18g >> 98g
Vậy ..x..g cần 78,6g >>..y..g
x= 78,6.80/18 = 349,3g
y= 78,6.98/18 = 427,9g
Trong loại oleum mới 10% thì mSO3 = 71a/100 -349,3g
và mH2SO4 = 29a/100 +52,4+ 427,9
=> 71a/100 -349,4 / 29a/100 +480,3 = 10/90
=> Bạn ấn máy tìm a nhé
Đúng 1
Bình luận (0)
1)Tính thể tích dung dịch H2SO4 1M thu được khi pha loãng 30ml dug dịch H2SO4 98%(D=1,84g/ml)
2)Tính khối lượng SO3 cần dùng để khi pha vào 200g dung dịch H2SO4 9,8% thu được dung dịch H2SO4 49%
3)Tính tỉ lệ khối lượng oleum 71% SO3 cần để khi trộn với dung dịch H2SO4 nguyên chất tạo oleum 62%SO3
1. \(n_{H_2SO_4\left(98\%\right)}=\dfrac{30.1,84.98\%}{98}=0,552\left(mol\right)\)
=>\(V_{H_2SO_4\left(1M\right)}=\dfrac{0,552}{1}=0,552\left(l\right)\)
Đúng 1
Bình luận (0)