Cho hh A gồm 2 kim loại K và Fe. Chia m gam hh A thành 2 phần bằng nhau:
- Cho phần 1 phản ứng hết với nước thu được 1,12 lít khí ở đktc
- Cho phần 2 phản ứng hết với axit HCl thi được 4,48 lít khí ở đktc
Tính m
cho 32,05 gam hỗn hợp gồm kim loại Zn và một kim loại A hóa trị II.
TN1: cho hh hợp kim loại phản ứng với H2SO4 loãng, dư thu được 4,48 lít khí đktc.
TN2: cho hh kim loại phản ứng với H2SO4 đặc, nóng thu được 11,2 lít khí đktc
Xác định kim loại A và thành phần phần trăm khối lượng mỗi kim loại trong hh.
Chia m gam hỗn hợp A gồm Fe, Cu thành 2 phần bằng nhau:
+ Phần 1 tác dụng với dung dịch HCl dư thu được 4,48 lít khí ở đktc.
+ Phần 2 tác dụng với 200 gam dung dịch H2SO4 98%, đun nóng. Sau phản ứng thu được dung dịch B và 13,44 lít khí ở đktc.
1. Tính m=?
2. Tính C% các chất trong dung dịch B
1)
- Xét phần 1:
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
0,2<-------------------0,2
=> nFe = 0,2 (mol)
- Xét phần 2:
\(n_{SO_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
PTHH: 2Fe + 6H2SO4 --> Fe2(SO4)3 + 3SO2 + 6H2O
0,2-->0,6-------->0,1--------->0,3
Cu + 2H2SO4 --> CuSO4 + SO2 + 2H2O
0,3<----0,6<------0,3<-----0,3
=> nCu = 0,3 (mol)
m = 2.(0,2.56 + 0,3.64) = 60,8 (g)
2)
\(m_{H_2SO_4\left(bđ\right)}=\dfrac{200.98}{100}=196\left(g\right)\)
=> \(m_{H_2SO_4\left(sau.pư\right)}=196-98\left(0,6+0,6\right)=78,4\left(g\right)\)
mdd sau pư = \(\dfrac{60,8}{2}+200-0,6.64=192\left(g\right)\)
\(\left\{{}\begin{matrix}C\%_{\left(Fe_2\left(SO_4\right)_3\right)}=\dfrac{0,1.400}{192}.100\%=20,83\%\\C\%_{\left(CuSO_4\right)}=\dfrac{0,3.160}{192}.100\%=25\%\\C\%_{\left(H_2SO_4.dư\right)}=\dfrac{78,4}{192}.100\%=40,83\%\end{matrix}\right.\)
Chia 43,4 gam hỗn hợp X gồm fe, zn, cu thành hai phần bằng nhau. Phần 1 tác dụng hoàn toàn với dd hcl dư thu được 4,48 lít khí h2 ( đktc ). Mặt khác, cho phần 2 phản ứng vừa đủ với 8,96 lít khí Cl2 ( đktc ). Tính khối lượng mỗi kim loại trong hỗn hợp X
Cho hỗn hợp gồm Fe và Fe2O3, chia hỗn hợp thành 2 phần bằng nhau: - Phần 1: Ngâm trong dd HCl dư, phản ứng xong thu đươc 4,48 lít khí H2 ở đktc. - Phần 2: cho luồng khí H2 đi qua phần 2 và nung nóng thu được 33,6 gam Fe. a. Viết pthh xảy ra. b. Tính thành phần % theo khối lượng mỗi chất trong hỗn hợp mk cần làm ko mạng nhé mk xin cảm ơn rất nhìu ạ.
Cho hh khí A gồm etien và một ankan có tổng thể tích là 8,96 lít. Chia A thành 2 phần bằng nhau:
- Đốt cháy hết phần 1 thu được 11,648 lít CO2.
- Cho phần 2 đi chậm qua bình đựng dd nước brom dư để phản ứng xảy ra hoàn toàn, thấy có 2,688 lít khí ra khỏi bình.
Xác định CTPT của ankan và tính % thể tích các khí trong A, các khí đều đo ở đktc.
Gọi số mol C2H4, CnH2n+2 trong mỗi phần là a, b (mol)
=> \(a+b=\dfrac{\dfrac{8,96}{2}}{22,4}=0,2\left(mol\right)\)
P1:
Bảo toàn C: 2a + bn = \(\dfrac{11,648}{22,4}=0,52\)
P2:
\(b=\dfrac{2,688}{22,4}=0,12\left(mol\right)\)
=> \(\left\{{}\begin{matrix}a=0,08\left(mol\right)\\n=3\end{matrix}\right.\)
=> CTPT: C3H8
\(\left\{{}\begin{matrix}\%V_{C_2H_4}=\dfrac{0,08}{0,2}.100\%=40\%\\\%V_{C_3H_8}=\dfrac{0,12}{0,2}.100\%=60\%\end{matrix}\right.\)
cho 32,05g hỗn hợp gồm kim loại Zn và một kim loại A hóa trị II
TN1: cho hh kim loại phản ứng với H2SO4 loãng dư thu được 4,48 lít khí đktc
TN2/; cho hh kim loại pứ với H2SO4 đặc, nóng thu được 11,2 lít khí đktc
Xác định tên kim loại A và thành phần phần trăm mỗi kim loại trong hỗn hợp
Cho 13,8 gam hỗn hợp X gồm kim loại kiềm R và Ca tác dụng hết với nước thu được 5,6 lít H2 (đktc) và dung dịch Y. Mặt khác, cho 8,58 gam kim loại R phản ứng hết với lượng dư dung dịch HCl thì thể tích khí H2 thoát ra lớn hơn 2,24 lít (đktc).
1. Tìm kim loại R?
2. Cho 15 lít hỗn hợp khí Z gồm N2 và CO2 (đktc) vào dung dịch Y. Sau khi phản ứng kết thúc thu được 8,5 gam kết tủa. Tính thành phần phần trăm về thể tích của mỗi khí trong hỗn hợp Z?
1.
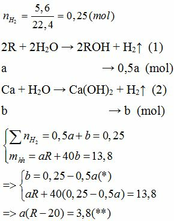
Vì b > 0, từ (*) => a < 0,25/0,5 = 0,5 thế vào (**)
=> R – 20 > 7,6
=> R > 27,6 (***)
Khi cho 8,58 gam R tác dụng với lượng dư HCl thì lượng H2 thoát ra lớn hơn 2,24 (lít)
2R + 2HCl → 2RCl + H2↑ (3)
Theo PTHH (3):
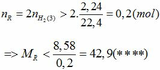
Từ (***) và (****) => 27, 6 < MR < 42,9
Vậy MR = 39 (K) thỏa mãn
2.
Ta có:
=> nKOH = nK = 0,2 (mol)
nCa(OH)2 = nCa = 0,15 (mol)
∑ nOH- = nKOH + 2nCa(OH)2 = 0,2 + 2.0,15 = 0,5 (mol)
Khi cho hỗn hợp Z ( N2, CO2) vào hỗn hợp Y chỉ có CO2 phản ứng
CO2 + OH- → HCO3- (3)
CO2 + 2OH- → CO32- + H2O (4)
CO32- + Ca2+ → CaCO3↓ (5)
nCaCO3 = 8,5/100 = 0,085 (mol) => nCO32-(5) = nCaCO3 = 0,085 (mol)
Ta thấy nCaCO3 < nCa2+ => phương trình (5) Ca2+ dư, CO32- phản ứng hết
TH1: CO2 tác dụng với OH- chỉ xảy ra phản ứng (4)
Theo (4) => nCO2 = nCO32-(4) = nCaCO3 = 0,085 (mol)
=> VCO2(đktc) = 0,085.22,4 = 1,904 (lít)
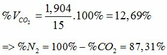
TH2: CO2 tác dụng với OH- xảy ra cả phương trình (3) và (4)
Theo (4): nCO2 = nCO32- = 0,085 (mol)
nOH- (4) = 2nCO32- = 2. 0,085 = 0,17 (mol)
=> nOH- (3)= ∑ nOH- - nOH-(4) = 0,5 – 0,17 = 0,33 (mol)
Theo PTHH (3): nCO2(3) = nOH- = 0,33 (mol)
=> ∑ nCO2(3+4) = 0,085 + 0,33 = 0,415 (mol)
=> VCO2 (ĐKTC) = 0,415.22,4 = 9,296 (lít)
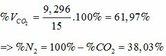
a) PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
b) Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)=n_{Fe}\) \(\Rightarrow m_{Fe}=0,2\cdot56=11,2\left(g\right)\)
\(\Rightarrow\%m_{Fe}=\dfrac{11,2}{28}\cdot100\%=40\%\) \(\Rightarrow\%m_{Ag}=60\%\)
a) Fe +2 HCl -> FeCl2 + H2
nH2=0,2(mol)
=> nFe=nH2=0,2(mol)
=>mFe=0,2.56=11,2(g)
b) %mFe=(11,2/28).100=40%
=>%mAg=100% - 40%=60%
Đem 28,6 gam hỗn hợp X gồm Al và Fe3O4 thực hiện phản ứng nhiệt nhôm trong điều kiện không có không khí, sau một thời gian thu được hỗn hợp Y. Chia Y thành 2 phần bằng nhau:
- Phần 1 cho phản ứng với dung dịch HNO3 đặc nóng dư thu được 7,84 lít khí NO2 (là sản phẩm khử duy nhất ở đktc).
- Phần 2 cho phản ứng vừa đủ với m gam dung dịch gồm HCl 7,3% và H2SO4 9,8%, sau phản ứng thu được 2,688 lít khí H2 (đktc).
Giá trị của m là
A. 160
B. 80
C. 320
D. 200