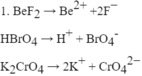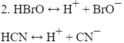Viết phương trình điện li của H2SO3.

Những câu hỏi liên quan
giúp mình viết phương trình điện li của các chất sau với ạ :
(Ag(NH3)2)Cl ; (Cu(NH3)4) (OH)2 ; H2C2O4( sẵn giải thích giùm mình ba chất này là chất gì luôn với)
NaHSO4 ; H2SO3
Viết phương trình chứng minh tính axit của H2SO3 yếu hơn HCl
PTHH: \(K_2SO_3+2HCl\rightarrow2KCl+H_2O+SO_2\uparrow\)
Đúng 1
Bình luận (0)
Carbonic acid is weaker than hydrochloric acid: + If Na2CO3 reacts with HCl, there is a reaction to create NaCl + H2O + CO2 + But if NaCl reacts with H2CO3, it will not create HCl and Na2CO3 => HCl is stronger than H2CO3 Equation (1) also proves that H2CO3 is a weak acid, it decomposes into water and CO2.
tiking me !translate it yourself!
Đúng 1
Bình luận (4)
Viết phương trình điện li của những chất sau: Các chất điện li yếu HClO; HNO2.
Viết phương trình hóa học minh họa: Tính axit của H2SO3 mạnh hơn H2CO3
1) Viết phương trình điện li của những chất điện li mạnh sau: HClO, KNO3, (NH4)2SO4, NaHCO3, Na3PO4
\(HClO\rightarrow H^++ClO^-\)
\(KNO_3\rightarrow K^++NO_3^-\)
\(\left(NH_4\right)_2SO_4\rightarrow2NH_4^++SO_4^{2-}\)
\(NaHCO_3\rightarrow Na^++HCO^-_3\left(HCO_3^-\leftrightarrow H^++CO_3^{2-}\right)\)
\(Na_3PO_4\rightarrow3Na^++PO_4^{3-}\)
Đúng 2
Bình luận (0)
Sự điện li, chất điện li là gì? Những loại chất nào là chất điện li? Thế nào là chất điện li mạnh, chất điện li yếu? Lấy thí dụ và viết phương trình điện li của chúng?
- Sự điện li là sự phân li thành các cation (ion dương) và anion (ion âm) của phân tử chất điện li khi tan trong nước.
- Chất điện li là những chất tan trong nước và tạo thành dung dịch dẫn được điện.
- Các chất là chất điện li như axit, các bazơ, các muối tan được trong nước.
- Chất điện li mạnh là những chất khi tan trong nước các phân tử hoà tan đều phân li ra ion.
- Thí dụ:
H2SO4 → 2H+ + SO42-
KOH → K+ + OH-
Na2SO4 → 2Na+ + SO42-
- Chất điện li yếu là những chất khi tan trong nước chỉ có một phần số phân tử hoà tan phân li ra ion, phần còn lại vẫn tồn tại dưới dạng phân tử trong dung dịch.
- Thí dụ: H2S ⇌ H+ + HS-
Đúng 0
Bình luận (0)
Viết phương trình điện li của các chất sau trong dung dịch:1. Các chất điện li mạnh :
B
e
F
2
,
H
B
r
O
4
,
K
2
C
r
O
4
.2. Các chất điện li yếu : HBrO, HCN.
Đọc tiếp
Viết phương trình điện li của các chất sau trong dung dịch:
1. Các chất điện li mạnh : B e F 2 , H B r O 4 , K 2 C r O 4 .
2. Các chất điện li yếu : HBrO, HCN.
Câu2: Viết phương trình điện li của những chất sau: a) Các chất điện li mạnh: Ba(NO3)2, HNO3, KOH. b) chất điện li yếu: HCLO, HNO2, H2CO3
a, \(Ba\left(NO_3\right)_2\rightarrow Ba^{2+}+2NO_3^-\)
\(HNO_3\rightarrow H^++NO_3^-\)
\(KOH\rightarrow K^++OH^-\)
b, \(HClO⇌H^++ClO^-\)
\(HNO_2⇌H^++NO_2^-\)
\(H_2CO_3⇌2H^++CO_3^{2-}\)
Đúng 1
Bình luận (0)
Câu 1: Xác định chất điện li và chất không điện li. Viết phương trình phân li của các chất điện li
a) \(NaCl\), \(CaCO_3\), \(Na_2CO_3\), \(NaHCO_3\), \(BaSO_3\), \(K_2SO_4\), \(NaCl\) khan
a) Chất điện li :
$NaCl \to Na^+ + Cl^-$
$Na_2CO_3 \to 2Na^+ + CO_3^{2-}$
$NaHCO_3 \to Na^+ + HCO_3^-$
$K_2SO_4 \to 2K^+ + SO_4^{2-}$
$CaCO_3 \to Ca^{2+} + CO_3^{2-}$
$BaSO_3 \to Ba^{2+} + SO_3^{2-}$
Chất không điện li : NaCl khan
Đúng 0
Bình luận (0)
\(NaCl\rightarrow Na^++Cl^-\\ NaCl_{khan}⇌Na^++Cl^-\\ CaCO_3⇌Ca^{2+}+CO^{2-}_3\\ NaHCO_3\rightarrow Na^++HCO^-_3\\ Na_2CO_3\rightarrow2Na^++CO^{2-}_3\\ BaSO_3⇌Ba^{2+}+SO^{2-}_3\\ K_2SO_4\rightarrow2K^++SO^{2-}_4\)
Đúng 0
Bình luận (1)
Viết phương trình cho mỗi chuyển đổi sau:
S -> SO2 -> H2SO3 -> Na2SO3
\(S+O_2\rightarrow SO_2\\ SO_2+H_2O\rightarrow H_2SO_3\\ H_2SO_3+2NaOH\rightarrow Na_2SO_3+2H_2O\)
Đúng 2
Bình luận (3)
S ---(1)---> SO2 ---(2)---> H2SO3 ---(3)---> Na2SO3.
(1) S + O2 ---to---> SO2
(2) SO2 + H2O \(⇌\) H2SO3
(3) H2SO3 + 2NaOH ---> Na2SO3 + 2H2O
Đúng 0
Bình luận (0)