Đốt cháy hoàn toàn 3,1 g photpho trong oxi dư. Cho toàn bộ sản phẩm tạo thành tác dụng với nước tạo thành 500 ml dd H3PO4
a.Viết các PTHH
b.Tính nồng độ mol của dung dịch tạo thành ( Cho P=31,H=1,O=16)
Giải chi tiết nha
Đốt cháy hoàn toàn 3,1 gam Photpho dư. Cho toàn bộ sản phẩm tạo thành tác dụng với H2O tạo thành 500 ml dung dịch
a) Viết phương trình
b) Tính CM của dung dịch tạo thành
Ghi tóm tắt, lời giải chi tiết rõ ràng
a) Phương trình phản ứng khi đốt cháy hoàn toàn 3,1 gam Photpho dư và cho sản phẩm tác dụng với H2O:
P4 + 502 → 2P205
P205 + 3H2O → 2H3PO4
b) Tính nồng độ mol của dung dịch tạo thành:
Đầu tiên, ta cần tính số mol của P4:
M(P4) = 31 x 4 = 124 g/mol n(P4) = m/M= 3,1/124 = 0,025 mol
+ Theo phương trình phản ứng, mỗi mol P4 sẽ tạo ra 2 mol H3PO4. Vậy số mol H3PO4 tạo thành là: n(H3PO4) = 2 x n(P4) = 0,05 mol
- Dung dịch có thể coi là pha rắn, о do đó khối lượng của dung dịch là khối lượng của H3PO4 tạo thành. Ta biết:
m(H3PO4) = n(H3PO4) x M(H3PO4) = 0,05 x 98 = 4,9 g
0 Thể tích dung dịch là 500 ml = 0,5 L. Vậy nồng độ mol của dung dịch là:
C = n(H3PO4)/V = 0,05/0,5 = 0,1 mol/L
Vậy nồng độ mol của dung dịch tạo thành là 0,1 mol/L.
Tóm tắt:
+ Số mol P4 = 0,025 mol
+ Số mol H3PO4 tạo thành = 0,05 mol
+ Khối lượng H3PO4 tạo thành = 4,9 g
Thể tích dung dịch = 500 ml = 0,5 L
+ Nồng độ mol của dung dịch tạo thành = 0,1 mol/L.
Đốt cháy hoàn toàn 3,1 gam Photpho dư. Cho toàn bộ sản phẩm tạo thành tác dụng với H2O tạo thành 500 ml dung dịch
a) Viết phương trình
b) Tính CM của dung dịch tạo thành
Ghi tóm tắt, lời giải chi tiết rõ ràng
a) Phương trình phản ứng giữa Photpho và O2:
P4 + 502 → 2P205
Phương trình phản ứng giữa P2O5 và H2O:
P205 + 3H2O → 2H3PO4
Tổng phương trình phản ứng:
P4+502 + 6H20 → 4H3PO4
b) Để tính nồng độ mol của dung dịch, ta cần biết số mol của H3PO4 trong dung dịch và thể tích của dung dich.
Số mol H3PO4 = số mol P4 đã phản ứng hết với O2
Theo phương trình phản ứng, ta có: 1 mol P4 tạo thành 4 mol H3PO4
Nồng độ mol của H3PO4 trong dung dich:
n(H3PO4) = (3,1 g P4 / 123,9 g/mol) x (4 mol H3PO4 / 1 mol P4) = 0,099 mol
Thể tích dung dịch là 500 ml = 0,5 L
Cô đặc dung dịch từ 500 ml xuống 250 ml, nồng độ mol của dung dịch sẽ tăng gấp đôi:
C(H3PO4)= n(H3PO4) / V(dung dịch) = 0,099 mol / 0,25 L = 0,396 M
Vậy, nồng độ mol của dung dịch là 0,396 M.
Đốt cháy hoàn toàn 6,2 g photpho trong oxi lấy dư. Cho sản phẩm tạo thành tác dụng với 150,0 ml dung dịch NaOH 2,0 M. Sau phản ứng, trong dung dịch thu được có các muối :

Đáp án: A.
Hướng dẫn:
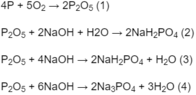
Số mol photpho: 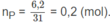
Số mol NaOH: ![]()
Sản phẩm tạo thành khi đốt photpho là P 2 O 5 .
Theo (1), số mol P 2 O 5 :
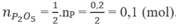
Ti lệ số mol NaOH và P 2 O 5 :
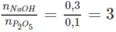
Tỉ lệ số mol nằm trong khoảng 2 và 4, do đó theo các phản ứng (2) và (3) trong dung dịch thu được có hai muối được tạo thành là N a H 2 P O 4 và N a 2 H P O 4 .
Đốt cháy hoàn toàn 6,2 gam photpho trong oxi dư. Cho sản phẩm tạo thành tác dụng vừa đủ với dung dịch NaOH 32% tạo ra muối Na2HPO4. Tính nồng độ phần trăm của muối trong dung dịch thu được sau phản ứng?
Theo pt: nNa2HPO4 = 2.nP2O5 = 0,1. 2 = 0,2 mol
Theo định luật bảo toàn khối lượng:
Khối lượng dung dịch sau phản ứng = khối lượng các chất tham gia phản ứng = mNaOH + mP2O5 = 50 + 0,1.142 = 64,2
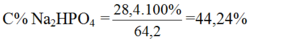
Đốt cháy hoàn toàn 6,2 gam photpho trong oxi dư. Cho sản phẩm tạo thành tác dụng với 50 gam dung dịch NaOH 32%. Muối tạo thành trong dung dịch phản ứng là
A. N a 2 H P O 4 .
B. N a 2 P O 4 .
C. N a H 2 P O 4 .
D. N a 2 H P O 4 , N a H 2 P O 4
Đốt cháy hoàn toàn 6,2 gam photpho trong oxi dư. Cho sản phẩm tạo thành tác dụng vừa đủ với dung dịch NaOH 32% tạo ra muối Na2HPO4. Tính khối lượng dung dịch NaOH đã dùng?
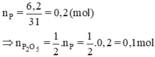
Theo pt: nNaOH = 4. nP2O5 = 4. 0,1 = 0,4 mol
Khối lượng NaOH = 0,4. 40 = 16 g
Khối lượng dung dịch NaOH = 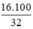 = 50,0 g
= 50,0 g
Đốt cháy hoàn toàn 6,2 gam photpho trong oxi dư. Cho sản phẩm tạo thành tác dụng vừa đủ với dung dịch NaOH 32% tạo ra muối Na2HPO4. Viết phương trình hoá học của các phản ứng xảy ra?
Phương trình phản ứng:
4P + 5O2 → 2P2O5 (1)
P2O5 + 4NaOH → 2Na2HPO4 + H2O (2)
Đốt cháy hoàn toàn m gam photpho trong oxi dư. Cho toàn bộ sản phẩm tạo thành vào 500 ml dung dịch chứa hỗn hợp NaOH 0,1M và KOH 0,2M đến khi các phản ứng xảy ra hoàn toàn, cô cạn dung dịch sau phản ứng, làm khô các chất thu được 9,448 gam chất rắn khan. Giá trị của m là
A. 1,426
B. 1,395
C. 1,302
D. 1,085
Đốt cháy hoàn toàn m gam photpho trong oxi dư. Cho toàn bộ sản phẩm tạo thành vào 500 ml dung dịch chứa hỗn hợp NaOH 0,1M và KOH 0,2M đến khi các phản ứng xảy ra hoàn toàn, cô cạn dung dịch sau phản ứng, làm khô các chất thu được 9,448 gam chất rắn khan. Giá trị của m là
A. 1,426.
B. 1,085.
C. 1,302.
D. 1,395.