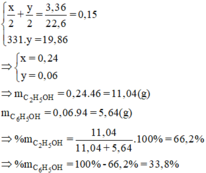Cho 1 lượng phenol tác dụng vừa đủ với 300ml dung dịch Br2 0,5M.Viết phương trình hoá học và tính khối lượng chất kết tủa trắng tạo thành

Những câu hỏi liên quan
Cho 80g copper (II) sulfate CuSO4 tác dụng vừa đủ với dung dịch potassium hydroxide KOH 1M a/ Viết phương trình hóa học? b/ Tính thể tích dung dịch potassium hydroxide đã sử dụng? c/ Tính khối lượng kết tủa tạo thành ?
\(a,PTHH:CuSO_4+2KOH\rightarrow Cu\left(OH\right)_2+K_2SO_4\\ b,n_{CuSO_4}=\dfrac{80}{160}=0,5\left(mol\right)\\ \Rightarrow n_{KOH}=2n_{CuCO_4}=1\left(mol\right)\\ \Rightarrow V_{dd_{KOH}}=\dfrac{1}{1}=1\left(l\right)\\ c,n_{Cu\left(OH\right)_2}=n_{CuSO_4}=0,5\left(mol\right)\\ \Rightarrow m_{Cu\left(OH\right)_2}=0,5\cdot98=49\left(g\right)\)
Đúng 1
Bình luận (0)
Câu 3 : Cho 100 ml dung dịch đồng (II) clorua tác dụng vừa đủ với 10 gam natri hidroxit, sau phản ứng thu được chất kết tủa. a) Viết phương trình hóa học . b) Tính khối lượng kết tủa tạo thành.c) Tính nồng độ mol của dung dịch đồng (II) clorua đã tham gia phản ứng
Đọc tiếp
Câu 3 : Cho 100 ml dung dịch đồng (II) clorua tác dụng vừa đủ với 10 gam natri hidroxit, sau phản ứng thu được chất kết tủa.
a) Viết phương trình hóa học .
b) Tính khối lượng kết tủa tạo thành.
c) Tính nồng độ mol của dung dịch đồng (II) clorua đã tham gia phản ứng
a, \(CuCl_2+2NaOH\rightarrow2NaCl+Cu\left(OH\right)_2\)
b, \(n_{NaOH}=\dfrac{10}{40}=0,25\left(mol\right)\)
Theo PT: \(n_{CuCl_2}=n_{Cu\left(OH\right)_2}=\dfrac{1}{2}n_{NaOH}=0,125\left(mol\right)\)
\(\Rightarrow m_{Cu\left(OH\right)_2}=0,125.98=12,25\left(g\right)\)
c, \(C_{M_{CuCl_2}}=\dfrac{0,125}{0,1}=1,25\left(M\right)\)
Đúng 3
Bình luận (0)
\(n_{NaOH}=\dfrac{10}{40}=0,25\left(mol\right)\)
a) PTHH : \(CuCl_2+2NaOH\rightarrow2NaCl+Cu\left(OH\right)_2\)
0,125<-----0,25---------------------->0,125
b) \(m_{Kt}=m_{Cu\left(OH\right)2}=0,125.98=12,25\left(g\right)\)
c) \(C_{MCuCl2}=\dfrac{0,125}{0,1}=1,25\left(M\right)\)
Đúng 1
Bình luận (0)
\(n_{NaOH}=\dfrac{10}{40}=0,25\left(mol\right)\)
PTHH:
\(CuCl_2+2NaOH\rightarrow Cu\left(OH\right)_2+2NaCl\)
0,125 0,25 0,125 0,25
\(m_{Cu\left(OH\right)_2}=0,125.98=12,25\left(g\right)\)
\(C_{M\left(CuCl_2\right)}=\dfrac{0,125}{0,1}=1,25\left(M\right)\)
Đúng 1
Bình luận (1)
cho 200(g) BaCl2 10,4(%) tác dụng vừa đủ với dung dịch H2SO4 (41,9%). a) viết phương trình phản ứng xảy ra. b) nếu cho quỳ tím cho vào dung dịch sau phản ứng quỳ tím có màu gì? c) tính khối lượng chất kết tủa tạo thành. d) tính khối lượng dung dịch H2SO4 4,9(%) đã dùng. e) tính nồng độ phần trăm dung dịch sau phản ứng
\(n_{BaCl_2}=\dfrac{200.10,4\%}{208}=0,1\left(mol\right)\\ a,BaCl_2+H_2SO_4\rightarrow BaSO_4+2HCl\\ b,Qu\text{ỳ}-t\text{í}m-ho\text{á}-\text{đ}\text{ỏ}-do-c\text{ó}-\text{ax}it-HCl\\ c,n_{BaSO_4}=n_{H_2SO_4}=n_{BaCl_2}=0,1\left(mol\right)\\ m_{k\text{ết}-t\text{ủa}}=m_{BaSO_4}=233.0,1=23,3\left(g\right)\\ d,m_{\text{dd}H_2SO_4}=\dfrac{0,1.98}{4,9\%}=200\left(g\right)\\ e,m_{\text{dd}HCl}=200+200-23,3=376,7\left(g\right)\\ n_{HCl}=0,1.2=0,2\left(mol\right)\\ C\%_{\text{dd}HCl}=\dfrac{0,2.36,5}{376,7}.100\approx1,938\%\)
Đúng 1
Bình luận (0)
Cho hỗn hợp gồm etanol và phenol tác dụng với natri (dư) thu được 3,36 lít khí hidro ở đktc. Nếu cho hỗn hợp trên tác dụng với dung dịch nước brom vừa đủ thu được 19,86 gam kết tủa trắng của 2,4,6-tribromphenol
Tính thành phần phần trăm khối lượng của mỗi chất trong hỗn hợp đã dùng.
Hòa tan hoàn toàn m gem Fe cần dùng 300ml dd CuSO4 1M (vừa đủ)
A) tính khối lượng kết tủa thu được
B) tính khối lượng FeSO4 tạo thành
C) cho NaOH tác dụng vừa đủ với dd FeSO4 trên tính khối lượng kết tủa tạo thành
a)
$Fe + CuSO_4 \to FeSO_4 + Cu$
Theo PTHH : $n_{Cu} = n_{CuSO_4} = 0,3.1 = 0,3(mol)$
$m_{Cu} = 0,3.64 = 19,2(gam)$
b) $n_{FeSO_4} = n_{CuSO_4} = 0,3(mol)$
$\Rightarrow m_{FeSO_4} = 0,3.152 = 45,6(gam)$
c) $FeSO_4 + 2NaOH \to Fe(OH)_2 + Na_2SO_4$
$n_{Fe(OH)_2} = n_{FeSO_4} = 0,3(mol)$
$m_{Fe(OH)_2} = 0,3.90 = 27(gam)$
Đúng 1
Bình luận (0)
Cho một dung dịch có chứa 52g BaCl2 tác dụng hoàn toàn với dung dịch H2SO4
19,6%.
a) Viết phương trình hóa học .
b) Tính khối lượng dung dịch H2SO4 cần dùng
c) Tính khối lượng chất kết tủa tạo thành
d) Lọc toàn bộ kết tủa, phần dung dịch còn lại được cho vào dung dịch có chứa 8g NaOH.
Hãy cho biết dung dịch sau phản ứng sẽ làm giấy quỳ tím thay đổi như thế nào?
(Cho: Ba 137; Cl 35,5; H 1; S 32; O 16; Na 23)
Đọc tiếp
Cho một dung dịch có chứa 52g BaCl2 tác dụng hoàn toàn với dung dịch H2SO4 19,6%. a) Viết phương trình hóa học . b) Tính khối lượng dung dịch H2SO4 cần dùng c) Tính khối lượng chất kết tủa tạo thành d) Lọc toàn bộ kết tủa, phần dung dịch còn lại được cho vào dung dịch có chứa 8g NaOH. Hãy cho biết dung dịch sau phản ứng sẽ làm giấy quỳ tím thay đổi như thế nào? (Cho: Ba = 137; Cl = 35,5; H = 1; S = 32; O = 16; Na = 23)
a) \(BaCl_2+H_2SO_4\rightarrow BaSO_4\downarrow+2HCl\)
b) \(n_{BaCl_2}=\dfrac{52}{208}=0,25\left(mol\right)\)
PTHH: \(BaCl_2+H_2SO_4\rightarrow BaSO_4\downarrow+2HCl\)
0,25----->0,25------->0,25---->0,5
=> \(m_{H_2SO_4}=0,25.98=24,5\left(g\right)\)
=> \(m_{ddH_2SO_4}=\dfrac{24,5.100}{19,6}=125\left(g\right)\)
c) \(m_{BaSO_4}=0,25.233=58,25\left(g\right)\)
d)
\(n_{NaOH}=\dfrac{8}{40}=0,2\left(mol\right)\)
PTHH: \(NaOH+HCl\rightarrow NaCl+H_2O\)
Xét tỉ lệ \(\dfrac{0,5}{1}>\dfrac{0,2}{1}\) => NaOH hết, HCl dư
=> Quỳ tím chuyển màu đỏ
Đúng 5
Bình luận (0)
Cho hỗn hợp gồm etanol và phenol tác dụng với natri (dư) thu được 3,36 lít khí hidro ở đktc. Nếu cho hỗn hợp trên tác dụng với dung dịch nước brom vừa đủ thu được 19,86 gam kết tủa trắng của 2,4,6-tribromphenol
a) Viết phương trình hóa học của các phản ứng xảy ra.
b) Tính thành phần phần trăm khối lượng của mỗi chất trong hỗn hợp đã dùng.
Số mol Br3C6H2OH = 19,86: 331,0 = 0,0600 (mol)
mphenol = 0,0600. 94,0 = 5,64 g
= 0,2400 mol
= 0,2400 . 46,0 = 11,05 g
Phần trăm khối lượng của etanol là 66,2% phần trăm khối lượng của phenol là 33,8%
Đúng 0
Bình luận (3)
Câu 5: Cho 8,1g nhôm tác dụng vừa đủ với dung dịch axit clohidric (HCI) 0,5M thu được nhôm clorua và khí hidro a) Viết phương trình hoá học. Tính thể tích khí hidro tạo thành (ở đktc). b) Tính khối lượng AlCl, tạo thành. c)Tính thể tích của dung dịch axit clohidric cần dùng.
a) 2Al + 6HCl → 2AlCl3 + 3H2
b) n Al= 8,1/27 =0,3(mol)
n H2 = 3/2 n Al = 0,45(mol)
V H2 = 0,45.22,4= 10,08 lít
c) n AlCl3 = n Al = 0,3 mol
m AlCl3 = 0,3.133,5 = 40,05(gam)
d) n HCl = 2n H2 = 0,9(mol)
=> V dd HCl = 0,9/0,5 = 1,8(lít)
Đúng 1
Bình luận (0)
Khi cho một lượng dung dịch phenol trong etanol với Na(dư) thấy sinh ra 6,72l khí ở (đktc). Nếu cho cùng lượng dung dịch đó tác dụng với nước Brom dư hì tạo thành 16,55gam kết tủa trắng. Tính thành phần % theo khối lượng phenol có trong hỗn hợp ban đầu
Theo đề bài ta có hệ phương trình:
\(\left\{{}\begin{matrix}\dfrac{x}{y}+\dfrac{y}{2}=\dfrac{6,72}{22,4}=0,3\\331y=16,55\end{matrix}\right.\)
Giải ra ta được :
x = 0,55
y = 0,05
=> \(mC_2H_5OH=0,55.46=25,3\left(g\right)\)
=> \(mC_6H_5OH=0,05.94=4,7\left(g\right)\)
=> \(\%m_{C_2H_5OH}=\dfrac{25,3.100}{25,3+4,7}=84,33\%\)
=> \(\%m_{C_6H_5OH}=100-84,33=15,67\%\)
Đúng 5
Bình luận (2)