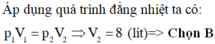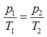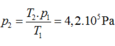Dưới áp suất 1pa 1 lượng khí có V=10 lít. Tính V của khí đó dưới áp suất 5pa

Những câu hỏi liên quan
Dưới áp suất 105Pa một lượng khí có thể tích 10 lít. Tính thể tích của khí đó dưới áp suất 3.105Pa A. 101. B. 3,31. C. 51. D. 301.
Đọc tiếp
Dưới áp suất 105Pa một lượng khí có thể tích 10 lít. Tính thể tích của khí đó dưới áp suất 3.105Pa
A. 101.
B. 3,31.
C. 51.
D. 301.
Một lượng khí ở áp suất 3.10 5 Pa có thể tích 8 lít. Sau khi đun nóng đẳng áp khí nở ra và có thể tích 10 lít.
a. Tính công khí thực hiện được.
b. Tính độ biến thiên nội năng của khí, biết trong khi đun nóng khí nhận được nhiệt lượng 1000J
a.Ta có
![]()
Công khí thực hiện được
![]()
b. Độ biến thiên nội năng của khí :
![]()
Đúng 0
Bình luận (0)
Một bình có dung tích V = 10 lít chứa một lượng khí hiđrô bị nén ở áp suất p = 50atm và nhiệt độ 70. Khi nung nóng bình, do bình hở nên có một phần khí thoát ra; phần khí còn lại có nhiệt độ 170C và vẫn dưới áp suất như cũ. Tính khối lượng khí đã thoát ra.
Gọi m1, m2 là khối lượng khí trong bình trước và sau khi nung nóng bình. Áp dụng phương trình Menđêlêep – Clapêrôn ta có:
p V = m 1 μ R T 1 , p V = m 2 μ R T 2 . ⇒ m 2 − m 1 = p V μ R ( 1 T 1 − 1 T 2 )
Với p = 50atm, V = 10 lít, μ = 2 g
R = 0 , 082 ( a t m . l / m o l . K ) Mà T 1 = 273 + 7 = 280 K ; T 2 = 273 + 17 = 290 K
⇒ m 2 − m 1 = 50.10.2 0 , 082 ( 1 280 − 1 290 ) m 2 - m 1 = 1 , 502 ( g )
Đúng 0
Bình luận (0)
Một bình có dung tích V = 10 lít chứa một lượng khí hiđrô bị nén ở áp suất p = 50atm và nhiệt độ 7 ° . Khi nung nóng bình, do bình hờ nên có một phần khí thoát ra; phần khí còn lại có nhiệt độ 17 ° C và vẫn dưới áp suất như cũ. Tính khối lượng khí đã thoát ra.
Gọi m i , rrn là khối lượng khí trong bình trước và sau khi nung nóng bình.
Áp dụng phương trình Menđêlêep - Clapêrôn ta có:
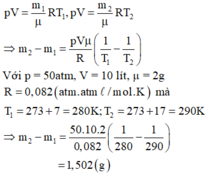
Đúng 0
Bình luận (0)
Dưới áp suất
10
5
Pa một lượng khí có thể tích là 10 lít. Nếu nhiệt độ được giữ không đổi và áp suất tăng lên
1
,
25.10
5
P
a
thì thể tích của lượng khí này là: A.
V
2
7
l
í
t
B.
V
2
...
Đọc tiếp
Dưới áp suất 10 5 Pa một lượng khí có thể tích là 10 lít. Nếu nhiệt độ được giữ không đổi và áp suất tăng lên 1 , 25.10 5 P a thì thể tích của lượng khí này là:
A. V 2 = 7 l í t
B. V 2 = 8 l í t
C. V 2 = 9 l í t
D. V 2 = 10 l í t
Dưới áp suất 3 atm một lượng khí có V1=10l. Tính thể tích của khí đó ở áp suất 2 atm
A. 1,5l
B. 5l
C. 15l
D. 7,4l
Dưới áp suất 10^5 Pa một lượng khí có thể tích là 10 lít. Nếu nhiệt độ được giữ không đổi và áp suất tăng lên 1,25.10^5 Pa thì thể tích của lượng khí này là:
Áp dụng quá trình đẳng nhiệt:
\(p_1\cdot V_1=p_2\cdot V_2\)
\(\Rightarrow10^5\cdot10=1,25\cdot10^5\cdot V_2\)
\(\Rightarrow V_2=8l\)
Đúng 2
Bình luận (0)
Một bình có dung tích V=10 lít chứa một lượng khí hidro bị nén ở áp suất p=50at,7oC. Khi nung nóng bình, do bình hở nên có một phần khí thoát ra; phần khí còn lại có nhiệt độ 17oC và vẫn dưới áp suất như cũ. Tính khối lượng khí đã thoát ra.
Gọi \(m_1;m_2\) là khối lượng khí trong bình trước và sau khi đun nóng bình. Áp dụng phương trình Menđêlêep - Clapêrông ta có: \(pV=\frac{m_1}{\mu}RT_1;pV=\frac{m_2}{\mu}RT_2\)
Từ đó suy ra khối lượng khí đã thoát ra:
\(m_2-m_1=\frac{pV\mu}{R}\left(\frac{1}{T_1}-\frac{1}{T_2}\right)\), với \(p=50atm,V=10\)lít \(,\mu=2g\)
\(R=0,084atm.l\text{/}mol.K;\)\(T_1=7+273=280K\)
\(T_2=17+273=290K\). Suy ra \(m_2-m_1=1,47g\)
Đúng 0
Bình luận (0)
Gọi m1,m2m1,m2 là khối lượng khí trong bình trước và sau khi đun nóng bình. Áp dụng phương trình Menđêlêep - Clapêrông ta có: pV=m1μRT1,pV=m2μRT2pV=m1μRT1,pV=m2μRT2
Từ đó suy ra khối lượng khí đã thoát ra:
m2−m1=pVμR(1T1−1T2)m2−m1=pVμR(1T1−1T2), với p=50atm,V=10lít,μ=2gp=50atm,V=10lít,μ=2g
R=0,084atm.l/mol.K;T1=7+273=280KR=0,084atm.l/mol.K;T1=7+273=280K
T2=17+273=290KT2=17+273=290K. Suy ra m2−m1=1,47g
Đúng 0
Bình luận (0)
Một bình thép chứa khí ở 270C dưới áp suất 6,3.10-5Pa, làm lạnh bình tới nhiệt độ -730C thì áp suất của khí trong bình là bao nhiêu? A. 6,3.10-5Pa B.17,03.10-5Pa C. 4,2.10-5Pa D.9,45.10-5Pa
Đọc tiếp
Một bình thép chứa khí ở 270C dưới áp suất 6,3.10-5Pa, làm lạnh bình tới nhiệt độ -730C thì áp suất của khí trong bình là bao nhiêu?
A. 6,3.10-5Pa
B.17,03.10-5Pa
C. 4,2.10-5Pa
D.9,45.10-5Pa