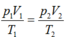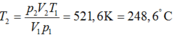Trước khi nén ,hỗn hơp khí trong xilanh có nhiệt độ 47°C.Sau khi nén áp suất tăng 8 lần,thể tích giảm 4 lần.hỏi nhiệt độ sau khi nén là bao nhiêu °C??

Những câu hỏi liên quan
Trước khi nén hỗn hợp khí trong xilanh của một động cơ có áp suất 1atm, nhiệt độ 50°C, thể tích xilanh là 600cm³. Sau khi nén thể tích giảm xuống còn 100cm³, áp suất là 8atm. Tính nhiệt độ khí sau khi nén?
600cm3 = 0,6l
100cm3 = 0,1l
Ta có
\(\dfrac{p_1V_1}{T_1}=\dfrac{p_2V_2}{T_2}\\ \Rightarrow T_2=\dfrac{p_2V_2.T_1}{p_1V_1}=\dfrac{8.0,1.323}{1.0,6}=430,6^oK\\ \Rightarrow t=157,6^o\)
Đúng 1
Bình luận (0)
Trước khi nén hỗn hợp khí trong xilanh của một động cơ có áp suất 1at, nhiệt độ 400C. Sau khi nén thể tích giảm đi 6 lần, áp suất 10at. Tìm nhiệt độ sau khi nén? A. 4000C B. 521,60C C. 248,60C D. 3130C
Đọc tiếp
Trước khi nén hỗn hợp khí trong xilanh của một động cơ có áp suất 1at, nhiệt độ 400C. Sau khi nén thể tích giảm đi 6 lần, áp suất 10at. Tìm nhiệt độ sau khi nén?
A. 4000C
B. 521,60C
C. 248,60C
D. 3130C
Trước khi nén hổn hợp khí trong xilanh của một động cơ có áp suất 1at, nhiệt độ 400C.Sau khi nén thể tích giảm đi 6 lần, áp suất 10at.Tìm nhiệt độ sau khi nén?
\(T_1=40^oC=313K\)
Thể tích ban đầu \(V_1\)
Thể tích lúc sau: \(V_2=\dfrac{1}{6}V_1\left(l\right)\)
Quá trình khí lí tưởng: \(\dfrac{p_1\cdot V_1}{T_1}=\dfrac{p_2\cdot V_2}{T_2}\)
\(\Rightarrow\dfrac{1\cdot V_1}{313}=\dfrac{10\cdot\dfrac{1}{6}V_1}{T_2}\)
\(\Rightarrow T_2=521,67K=248,67^oC\)
Đúng 3
Bình luận (0)
Trong xilanh của một động cơ có chứa một lượng khí ở nhiệt độ 470C và áp suất 0,7 atm.Sau khi bị nén thể tích của khí giảm đi 5 lần và áp suất tăng lên tới 8 atm. Tính nhiệt độ của khí ở cuối quá trình nén? A. 7310C B. 320 K C. 3200C D. 731K
Đọc tiếp
Trong xilanh của một động cơ có chứa một lượng khí ở nhiệt độ 470C và áp suất 0,7 atm.Sau khi bị nén thể tích của khí giảm đi 5 lần và áp suất tăng lên tới 8 atm. Tính nhiệt độ của khí ở cuối quá trình nén?
A. 7310C
B. 320 K
C. 3200C
D. 731K
Đáp án D
TT1
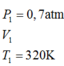
TT2

áp dụng PTTT khí lí tưởng
ta có:
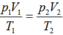
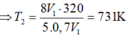
Đúng 0
Bình luận (0)
Trong xilanh của một động cơ có chứa một lượng khí nhiệt độ 40 độ C và áp suất 0,6atm . Sau khi bị nén , thể tích của khí giảm đi 4 lần và áp suất tăng lên tới 5atm . Tính nhiệt độ của khí ở cuối quá trình trên .
Trạng thái 1: \(\left\{{}\begin{matrix}p_1=0,6atm\\V_1\\T_1=40^oC=313K\end{matrix}\right.\)
Trạng thái 2: \(\left\{{}\begin{matrix}p_2=5atm\\V_2=\dfrac{1}{4}V_1\\T_2=???\end{matrix}\right.\)
Quá trình khí lí tưởng:
\(\dfrac{p_1V_1}{T_1}=\dfrac{p_2V_2}{T_2}\Rightarrow\dfrac{0,6\cdot V_1}{313}=\dfrac{5\cdot\dfrac{1}{4}V_1}{T_2}\)
\(\Rightarrow T_2=652,083K=379,083^oC\)
Đúng 3
Bình luận (0)
Thể tích của hỗn hợp khí trong xi-lanh là 2 d m 3 , nhiệt độ là 47 ° C và áp suất ban đầu là 1atm. Tính nhiệt độ của hỗn hợp khí trong xi-lanh khi pit-tông nén khí trong xi-lanh làm thể tích giảm đi 10 lần, áp suất tăng đến 15atm.
A. 480K
B. 450K
C. 840K
D. 540K
Đáp án: A
Ta có:
- Trạng thái 1: T 1 = 47 + 273 = 320 K p 1 = 1 a t m V 1 = 2 l
- Trạng thái 2: T 2 = ? p 2 = 15 a t m V 2 = 0,2 l
Áp dụng phương trình trạng thái của khí lý tưởng, ta có:
p 1 V 1 T 1 = p 2 V 2 T 2 ↔ 1.2 320 = 15.0,2 T 2 → T 2 = 480 K
Đúng 0
Bình luận (0)
Một lượng khí đựng trong xilanh có pittông chuyển động được. Các thông số của lượng khí này là: 2atm, 15 lít, 27 độ C. Khi pit tông bị nén, áp suất tăng lên tới 4atm, thể tích giảm còn 5 lít. Xác định nhiệt độ khi nén
\(\left\{{}\begin{matrix}p_1=2atm\\V_1=15\\T_1=300^oK\end{matrix}\right.\\ \left\{{}\begin{matrix}p_2=4atm\\V_2=10l\\T_2=?^oK\end{matrix}\right.\\ \dfrac{p_1V_1}{T_1}=\dfrac{p_2V_2}{T_2}\Leftrightarrow\dfrac{2.15}{300}=\dfrac{4.10}{T_2}\\ \Rightarrow T_2=400^oK\Rightarrow t_2=127^o\)
Đúng 2
Bình luận (0)
refer
https://cdn.lazi.vn/storage/uploads/edu/answer/1490800797_13.jpg
Đúng 1
Bình luận (0)
Một lượng khí xác định có áp suất 10⁵ Pa nhiệt độ 27°C sau khi bị nén thể tích khí giảm đi 3 lần áp suất tăng lên đến 5.10⁵Pa .Tính nhiệt độ cuối quá trình nén
\(T_1=27^oC=300K\)
\(V_2=\dfrac{1}{3}V_1\)
Phương trình trạng thái khí lí tưởng:
\(\dfrac{p_1.V_1}{T_1}=\dfrac{p_2.V_2}{T_2}\)
\(\Leftrightarrow\dfrac{10^5.V_1}{300}=\dfrac{5.10^5.\dfrac{1}{3}V_1}{T_2}\)
\(\Leftrightarrow T_2=500K\)
Đúng 1
Bình luận (0)
Trong xilanh của một động cơ đốt trong có 2 dm 3 hỗn hợp khí dưới áp suất l75atm và nhiệt độ 47 ° C. Pit tông nén xuống làm cho thế tích của hỗn hợp khí chi còn 0,2 dm 3 và áp suất tăng lên 21atm. Tính nhiệt độ của hỗn hợp khí nén.