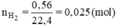Cho một lượng bột sắt dư vào 500 ml dung dịch HCl thu được 33,6 l khí Hiđro ở dktc
A) tính khối lượng của bột sắt
B) xác định nồng độ mol H2SO4 đã dùng
C) cho 10g Cu và CuO tác dụng với dung dịch H2SO4 loãng lấy chất rắn không tan cho vào H2SO4 đã nóng thì thu được 1,12 l khí A(dktc). Tính thành phần phần trăm mỗi chất trong hỗn hợp ban đầu