Dùng 150 gam quặng pirit chứa 20% chất trơ điều chế H2SO4 . Đem toàn bộ lượng axit điều chế được hòa tan vừa đủ m gam Fe2O3 . Tât cả PƯ xảy ra hoàn toàn . Hãy : a) Tính khối lượng H2SO4 điều chế được ? b) Tính m?
giúp mk với các tình yêu nha.❤
Dùng 150 gam quặng pirit chưá 20% chất trơ điều chế H2SO4 . Đem toàn bộ lượng axit điều chế được hòa tan vừa đủ m gam Fe2O3 . Tất cả phản ứng xảy ra hoàn toàn , hãy
a. Tính khối lượng H2SO4 điều chế được ?
b. Tính m ?
vì trong quặng pirit chứa 20% chất trơ nên FeS2 chiếm 80% trong quặng pirit nên ta có:
m FeS2 = \(\dfrac{150\cdot80}{100}=120\left(g\right)\)
PTHH
4FeS2 + 11O2 -to-> 2Fe2O3 + 8SO2
2SO2 + O2 -to- V2O5 -> 2SO3
SO3 + H2O -> H2SO4
Từ ba phương trình hóa học trên ta có chuỗi phản ứng:
FeS2 -> 2 SO2 -> 2 SO2 -> 2 H2SO4
1mol ->2 mol ->2 mol ->2mol
120g------------------------>196g
120g------------------------->196g
vậy điều chế được 196 g H2SO4
n H2SO4 = \(\dfrac{m}{M}=\dfrac{196}{98}=2\left(mol\right)\)
Fe2O3 + 3H2SO4 -> Fe2(SO4)3 + 3H2O
1 mol---3mol---------1mol-----------3mol
2/3 mol <-2mol
mFe2O3 = n*M = \(\dfrac{2}{3}\cdot160\approx106,7\left(g\right)\)
Dùng 300 g quặng pirit chứa 20 phần trăm chất trơ điều chế H2SO4. Đem toàn bộ lượng axit điều chế được hòa tan vừa đủ m (g) Fe2O3. Biết tất cả phản ứng xảy ra hoàn toàn, hãy:
a.Tính m H2SO4 điều chế được.
b.Tính m.
Giúp mik với mai mik nộp ùi![]()
Từ 45kg quặng pirit sắt có chứa 20% tạp chất dùng để điều chế H2SO4 70% với hiệu suất của toàn bộ quá trình là 60%. Tính khối lượng H2SO4 70% thu được.
\(m_{FeS_2}=45-45.20:100=36kg\\ FeS_2\rightarrow H_2SO_4\\ \Rightarrow2n_{FeS_2}=n_{H_2SO_4\left(lt\right)}\\ \Rightarrow2\cdot\dfrac{36}{120}=\dfrac{m_{H_2SO_4\left(lt\right)}}{98}\\ \Rightarrow m_{H_2SO_4\left(lt\right)}=58,8kg\\ m_{H_2SO_4\left(tt\right)}=58,8.60:100=35,28kg\\ m_{H_2SO_4,70\%}=35,28.100:70=50,4kg\)
Trong công nghiệp, axit sunfuric được điều chế từ quặng pirit sắt. Khối lượng dung dịch H 2 S O 4 98% điều chế được từ 1,5 tấn quặng pirit sắt có chứa 80% F e S 2 (hiệu suất toàn quá trình là 80%) là
A. 0,80 tấn
B. 1,60 tấn
C. 1,25 tấn
D. 2,00 tấn
Trong công nghiệp, axit sunfuric được điều chế từ quang pirit sắt. Khối lượng H2SO4 điều chế được từ 1,5 tấn quặng pirit sắt có chứa 80% FeS2 ( hiệu suất toàn quá trình là 80%) là:
A. 1,568 tấn
B. 1,96 tấn
C. 1,25 tấn
D. 2,00 tấn
Đáp án A.
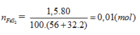
FeS2 → 2H2SO4 (Bảo toàn S)
0,01 → 0,02 (mol)
Do hiệu suất là 80%
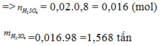
Câu 1. Dùng 100 tấn quặng pirit sắt chứa 72% FeS2 để điều chế H2SO4. Cho toàn bộ axit thu được tác dụng vs Cu điều chế CuSO4.5H2O sau đó pha thành dd CuSO4 để trừ nấm thực vật. Tính m (tấn) CuSO4.5H2O thu được. biết hiệu suất cả quá trình là 80%.
Từ một tấn quặng pirit sắt chứa 20% tạp chất, điều chế H2SO4 theo phương pháp tiếp xúc theo các giai đoạn sau:
FeS2 --90%--> SO2 --64%--> SO3 --80%--> H2SO4
Tính khối lượng dd H2SO4 72% điều chế được?
m(FeS2)=(100%-20%).1=0,8(tấn)
4 FeS2 + 11 O2 -to,xt-> 2 Fe2O3 + 8 SO2
\(mSO2\left(LT\right)=\dfrac{0,8.512}{480}=\dfrac{64}{75}\left(tấn\right)\\ \rightarrow mSO2\left(TT\right)=\dfrac{64}{75}.90\%=\dfrac{96}{125}\left(tấn\right)\)
SO2 + 1/2 O2 \(⇌\) SO3
\(mSO3\left(LT\right)=\dfrac{\dfrac{96}{125}.80}{64}=\dfrac{24}{25}\left(tấn\right)\\ mSO3\left(TT\right)=\dfrac{24}{25}.64\%=\dfrac{384}{625}\left(tấn\right)\)
SO3+ H2O -> H2SO4
\(mH2SO4\left(LT\right)=\dfrac{\dfrac{384}{625}.98}{80}=\dfrac{2352}{3125}\left(tấn\right)\\ mH2SO4\left(TT\right)=\dfrac{2352}{3125}.80\%=\dfrac{9408}{15625}\left(tấn\right)\)
=> \(mddH2SO4\left(72\%\right)=\dfrac{\dfrac{9408}{15625}.100}{72}=0,836\left(tấn\right)\)
m(FeS2)=(100%-20%).1=0,8(tấn)
4 FeS2 + 11 O2 -to,xt-> 2 Fe2O3 + 8 SO2
mSO3(LT)=96125.8064=2425(tấn)mSO3(TT)=2425.64%=384625(tấn)���3(��)=96125.8064=2425(�ấ�)���3(��)=2425.64%=384625(�ấ�)
SO3+ H2O -> H2SO4
mddH2SO4(72%)=940815625.10072=0,836(tấn)
10. Dùng 150 gam quặng pirit chưá 20% chất trơ điều chế H2SO4. Đem toàn bộ lượng axit điều chế được hòa tan vừa đủ m gam Fe2O3. Tất cả phản ứng xảy ra hoàn toàn, hãy
a. Tính khối lượng H2SO4 điều chế được?
b. Tính m?
11. Từ 1 tấn quặng pirit chưá 90% FeS2 có thể điều chế bao nhiêu lít H2SO4 đậm đặc 98% (d = 1,84 g/ml), biết hiệu suất trong quá trình điều chế là 80%?
Bài 8: Để hòa tan hết 2,04 gam Al2O3 cần dùng vừa đủ 200ml dung dịch HCl. Hãy tính CM của dung dịch axit đã dùng.
Bài 9: Hoà tan hoàn toàn 3,2 gam Fe2O3 trong dung dịch H2SO4 19,6% vừa đủ.
a. Tính khối lượng dung dịch axit đã dùng?
b, Xác định chất tan có trong dung dịch thu được.Tính khối lượng của chất tan đó.
Bài 10: Hòa tan hoàn tòa 10,8 gam nhôm trong 200 gam dung dịch H2SO4 thì vừa đủ. Khi phản ứng kết thúc hãy tính:
a. Thể tích H2 thu được ở đktc.
b. C% dung dịch axit đã dùng.
Bài 9 :
\(a) n_{Fe_2O_3} = \dfrac{3,2}{160}=0,02(mol)\\ Fe_2O_3 + 3H_2SO_4 \to Fe_2(SO_4)_3 + 3H_2O\\ n_{H_2SO_4} = 3n_{Fe_2O_3} = 0,06(mol)\\ m_{dd\ H_2SO_4} = \dfrac{0,06.98}{19,6\%} = 30(gam)\\ b) \text{Chất tan : } Fe_2(SO_4)_3\\ n_{Fe_2(SO_4)_3} = n_{Fe_2O_3} = 0,02(mol)\\ m_{Fe_2(SO_4)_3} = 0,02.400 =8(gam)\)
Bài 8 :
\(n_{Al_2O_3} = \dfrac{2,04}{102} = 0,02(mol)\\ Al_2O_3 + 6HCl \to 2AlCl_3 + 3H_2O\\ n_{HCl} = 6n_{Al_2O_3} = 0,02.6 = 0,12(mol)\\ C_{M_{HCl}} = \dfrac{0,12}{0,2} =0,6M\)