Khối lượng của nhôm bằng bao nhiêu gam

Những câu hỏi liên quan
Khối lượng của nhôm bằng bao nhiêu gam
\(m_{Al}\)=27.đvc=27. \(1,66.10^{-24}\)=\(4,482.10^{-23}\)(g)
Đúng 0
Bình luận (0)
. Khối lượng tính bằng gam của nguyên tử cacbon là 1,9926.10-23g
a) 1 đvC tương ứng với bao nhiêu gam?
b) Tính khối lượng bằng gam của oxi, sắt, natri, clo, kẽm, nhôm, photpho.
\(a,m_{1đ.v.C}=\dfrac{1,9926.10^{-23}}{12}=0,16605.10^{-23}\left(g\right)\\ b,m_O=0,16605.10^{-23}.16=2,6568.10^{-23}\left(g\right)\\ m_{Fe}=56.0,16605.10^{-23}=9,2988.10^{-23}\left(g\right)\\ m_{Na}=23.0,16605.10^{-23}=3,81915.10^{-23}\left(g\right)\\ m_{Cl}=35,5.0,16605.10^{-23}=5,894775.10^{-23}\left(g\right)\\ m_{Zn}=65.0,16605.10^{-23}=10,79325.10^{-23}\left(g\right)\\ m_{Al}=27.0,16605.10^{-23}=4,48335.10^{-23}\left(g\right)\\ m_P=31.0,16605.10^{-23}=5,14755.10^{-23}\left(g\right)\)
Đúng 2
Bình luận (0)
Biết giá trị khối lượng tính bằng gam của nguyên tử cacbon là 1,9926.10-23 (g). Hãy tính xem một đơn vị cacbon tương ứng bao nhiêu gam? Khối lượng tính bằng gam của nguyên tử nhôm là A, B, C hay D?
a. Ta có : C = 12 đvC = 1,9926.10-23 (g)
=> 1 đvC = (1,9926.10-23) : 12 ≈ 1,66.10-24 (g).
b. Khối lượng tính bằng gam của nguyên tử nhôm là :
mAl = 27 đvC = 27. 1,66.10-24 = 4,482.10-23 (g)
Đúng 2
Bình luận (6)
Khối lượng tính bằng gam của một nguyên tử nhôm (13 proton, 13 electron và 14 nơtron) là bao nhiêu?
khối lượng nguyên tử = khối lượng hạt nhân
MAl = 13+14 =27 đvC
học tốt
Đúng 0
Bình luận (0)
Nếu nAl = 1 mol => mAl = 27.1=27g
học tốt
Bảng tuần hoàn nguyên tố hóa học 8 trang 42 có cả nha bạn
học tốt
Đúng 0
Bình luận (0)
cho một bản nhôm có khối lượng 70 gam vào dung dịch CuS04 sau một thời gian lấy bản nhôm ra cân có khối lượng 76,9 gam .Khối lượng đồng bám vào bản nhôm là bao nhiêu?
PTHH: 2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
( Gọi số mol của Al phản ứng là: 2a => số mol Cu là: 3a )
Vì khối lượng bản nhôm tăng lên bằng tổng khối lượng Cu bám vào trừ khối lượng Al phản ứng
<=> 76,9 - 70 = (3a. 64) - (2a. 27)
<=> 6,9 = 138a
<=> a = 0,05
=> Khối lượng đòng bám vào bản nhôm là: 64 . 3a = 64 . 3 . 0,05 = 9,6 (gam)
Đúng 1
Bình luận (0)
2Al+ 3CuSO4----> Al2(SO4)3 +3 Cu
a 3/2a mol
Vì khối lượng thanh nôm sau phản ứng tăng
=>m tăng=76,9-70=mCu bám vào - mAl tan ra=3/2a .64-a.65=> a=69/310 mol
=> khối lượng Cu bám vào bằng=21,36 gam
Đúng 0
Bình luận (0)
a) Theo giá trị khối lượng tính bằng gam của nguyên tử cacbon cho trong bài học, hãy tính xem một đơn vị cacbon tương ứng với bao nhiêu gam? b) Khối lượng tính bằng gam của nguyên tử nhôm là A, B, C hay D? A. 5,324.10-23g. B. 6,023.10-23g. C. 4,482.10-23g. D. 3,990.10-23g.
Đọc tiếp
a) Theo giá trị khối lượng tính bằng gam của nguyên tử cacbon cho trong bài học, hãy tính xem một đơn vị cacbon tương ứng với bao nhiêu gam?
b) Khối lượng tính bằng gam của nguyên tử nhôm là A, B, C hay D?
A. 5,324.10-23g.
B. 6,023.10-23g.
C. 4,482.10-23g.
D. 3,990.10-23g.
a) Ta có khối lượng 1 nguyên tử C = 1,9926 . 10-23 g và bằng 12 đvC
⇒ khối lượng của 1 đơn vị cacbon là
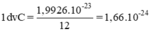
b) Khối lượng tính bằng gam của nguyên tử nhôm
Nhân số trị nguyên tử khối của nhôm với số gam tương ứng của một đơn vị cacbon
MAl = 27x 1,66.10-24 g = 44,82.10-24 g = 4,482.10-23 g.
Đáp án C.
Đúng 0
Bình luận (0)
cho biết hạt nhân nguyên tử nhôm có 13p và 14n. a) số lượng electron ở lớp vỏ là bao nhiêu? b) tính khối lượng của nguyên tử nhôm ( theo gam)? c) Tính tỉ số khối lượng của electron trong nguyên tử nhôm so với khối lượng của toàn nguyên tử. Từ kếu quả đó có thể coi khối lượng nguyên tử thực tế bằng khối lương hạt nhân được không?
Cho 58,5 gam nhôm hidroxit tác dụng với 49 gam dd axit sunfuric, sau phản ứng thu
được nhôm sufat và nước.
a. Viết PTHH
b. Sau phản ứng chất nào còn dư ? Khối lượng dư là bao nhiêu gam?
c. Tính khối lượng nhôm sunfat tạo thành.
a. PTHH: 2Al(OH)3 + 3H2SO4 ---> Al2(SO4)3 + 6H2O
b. Ta có: \(n_{Al\left(OH\right)_3}=\dfrac{58,5}{78}=0,75\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{49}{98}=0,5\left(mol\right)\)
Ta thấy: \(\dfrac{0,75}{2}>\dfrac{0,5}{3}\)
Vậy \(Al\left(OH\right)_3\) dư.
\(m_{dư}=0,75.78-98.0,5=9,5\left(g\right)\)
c. Theo PT: \(n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{3}.n_{H_2SO_4}=\dfrac{1}{3}.0,5=\dfrac{1}{6}\left(mol\right)\)
=> \(m_{Al_2\left(SO_4\right)_3}=\dfrac{1}{6}.342=57\left(g\right)\)
Đúng 0
Bình luận (0)
Cho 58,5 gam nhôm hidroxit tác dụng với 49 gam dd axit sunfuric, sau phản ứng thu
được nhôm sufat và nước.
a. Viết PTHH
b. Sau phản ứng chất nào còn dư ? Khối lượng dư là bao nhiêu gam?
c. Tính khối lượng nhôm sunfat tạo thành.
a, \(n_{Al\left(OH\right)_3}=\dfrac{58,5}{78}=0,75\left(mol\right);n_{H_2SO_4}=\dfrac{49}{98}=0,5\left(mol\right)\)
PTHH: 2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O
Mol: \(\dfrac{1}{3}\) 0,5 \(\dfrac{1}{6}\)
b, Ta có: \(\dfrac{0,75}{2}>\dfrac{0,5}{3}\) ⇒ Al(OH)3 dư, H2SO4 hết
⇒ \(m_{Al\left(OH\right)_3}=\left(0,75-\dfrac{1}{3}\right).78=32,5\left(g\right)\)
c, \(m_{Al_2\left(SO_4\right)_3}=\dfrac{1}{6}.342=57\left(g\right)\)
Đúng 5
Bình luận (2)
Ta có: \(n_{Al\left(OH\right)_3}=\dfrac{58,5}{78}=0,75\left(mol\right)\)
a. PTHH: 2Al(OH)3 + 3H2SO4 ---> Al2(SO4)3 + 6H2O
b. Không có chất dư (hoặc có thể bn cho sai 49(g) dung dịch là 49(g) H2SO4)
c. Theo PT: \(n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{2}.n_{Al\left(OH\right)_3}=\dfrac{1}{2}.0,75=0,375\left(mol\right)\)
=> \(m_{Al_2\left(SO_4\right)_3}=0,375.342=128,25\left(g\right)\)
Đúng 0
Bình luận (1)
























