từ KMnO4-->O2-->Fe3O4.
biết số mol cụa Fe3O4 là 0.4. Tìm số mol của KMnO4
Trong phòng thí nghiệm người ta điều chế oxit sắt từ Fe3O4 bằng cách dùng oxi hóa sắt ở nhiệt độ cao.
a) Tính số gam sắt và oxi cần dùng để điều chế được 2,32g oxi sắt từ?
b) Tính số gam kali pemanganat KMnO4 cần dùng để có được lượng oxi dùng cho phản ứng trên, biết rằng khi nung nóng 2 mol KMnO4 thì thu được 1 mol O2.
a) Phương trình hóa học của phản ứng:
3Fe + 2O2 → Fe3O4.
nFe3O4 = 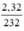 = 0,01 mol.
= 0,01 mol.
nFe = 3.nFe3O4 = 0,01 .3 = 0,03 mol.
nO2 = 2.nFe3O4 = 0,01 .2 = 0,02 mol.
mFe = 0,03.56 = 1,68g.
mO2 = 0,02.32 = 0,64g.
b) Phương trình phản ứng nhiệt phân KMnO4:
2KMnO4 → K2MnO4 + MnO2 + O2
nKMnO4 = 2.nO2 = 0,02.2 = 0,04 mol.
mKMnO4 = 0,04 .158 = 6,32g.
1. Xác định hóa trị của các nguyên tố trong các hợp chất sau: H2O, Cu2O,H2SO4, H3PO4, FeO, Fe2O3, Fe3O4, FexOy, KMnO4, K2Cr2O7.2. Điền từ thích hợp vào chỗ trống:Một mol …… (1), ……. (2), …… (3) tuy đều có số ……. (4) bằng nhau là……. (5) nhưng chiếm thể tích ….. (6) vì thể tích của một mol chất phụthuộc vào …….. (7) của phân tử và …… (8) giữa các phân tử, mà các chấtkhác nhau thì phân tử của chúng có …….. (7) và ……. (8) giữa chúng khác
Xem nội dung đầy đủ tại: https://123docz.net/document/4520526-de-thi-olympic-hoa-hoc-lop-8-4740.htm
1. Xác định hóa trị của các nguyên tố trong các hợp chất sau:
H2O (H hóa trị I, O hóa trị II).
Cu2O (Cu hóa trị I, O hóa trị II).
H2SO4 (H hóa trị I, S hóa trị VI, O hóa trị II).
H3PO4 (H hóa trị I, P hóa trị V, O hóa trị II).
FeO (Fe hóa trị II, O hóa trị II).
Fe2O3 (Fe hóa trị III, O hóa trị II).
Fe3O4 (Fe hóa trị I và II, O hóa trị II).
FexOy (Fe hóa trị 2y/x, O hóa trị II).
KMnO4 (K hóa trị I, Mn hóa trị VII, O hóa trị II).
K2Cr2O7 (K hóa trị I, Cr hóa trị VI, O hóa trị II).
2. Điền từ thích hợp vào chỗ trống:
Một mol chất rắn, chất lỏng, chất khí tuy đều có số phân tử là bằng nhau nhưng chiếm thể tích khác nhau vì thể tích của một mol chất phụ thuộc vào kích thước của phân tử và khoảng cách giữa các phân tử, mà các chất khác nhau thì phân tử của chúng có kích thước và khoảng cách giữa chúng khác nhau.
Hòa tan a mol Fe3O4 trong 8a mol dung dịch H2SO4 loãng thu được dung dịch X. Cho các chất sau: Cl2, O2, Cu, NaNO3, HNO3, HCl, KMnO4 và BaCl2. Số chất khi cho vào X thấy có phản ứng hóa học xảy ra là?
A. 5
B. 8
C. 6
D. 7
Đáp án D
Cl2, O2, Cu, NaNO3, HNO3, KMnO4 và BaCl2
Hòa tan a mol Fe3O4 trong 8a mol dung dịch H2SO4 loãng thu được dung dịch X. Cho các chất sau: Cl2, O2, Cu, NaNO3, HNO3, HCl, KMnO4 và BaCl2. Số chất khi cho vào X thấy có phản ứng hóa học xảy ra là?
A. 5
B. 8
C. 6
D. 7
Đáp án D
Cl2, O2, Cu, NaNO3, HNO3, KMnO4 và BaCl2
Hòa tan a mol Fe3O4 trong 8a mol dung dịch H2SO4 loãng thu được dung dịch X. Cho các chất sau: Cl2, O2, Cu, NaNO3, HNO3, HCl, KMnO4 và BaCl2. Số chất khi cho vào X thấy có phản ứng hóa học xảy ra là?
A. 5
B. 8
C. 6
D. 7
Đáp án D
Cl2, O2, Cu, NaNO3, HNO3, KMnO4 và BaCl2
Cho KI tác dụng với dung dịch KMnO4 trong môi trường H2SO4, người ta thu được 1,51 gam MnSO4 theo phưong trình phản ứng sau: KI + KMnO4 + H2SO4 g I2 +... Số mol I2 tạo thành và số mol KI phản ứng là:
A. 0,00025 và 0,0005
B. 0,025 và 0,05
C. 0,25 và 0,5
D. 0,0025 và 0,005
Đáp án B
Bước đầu tiên, cần hoàn thành phương trình phản ứng với đầy đủ các chất và hệ số:
![]()
![]()
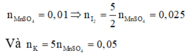
Nhận xét: Ngoài việc viết đầy đủ phản ứng như trên, các bạn vẫn có thể giải quyết bài toán bằng việc áp dụng định luật bảo toàn moi electron và bảo toàn nguyên tố:

Áp dụng định luật bào toàn mol electron, ta có:
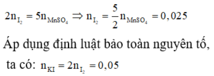
Cho KI tác dụng với dung dịch KMnO4 trong môi trường H2SO4, người ta thu được 1,51 gam MnSO4 theo phưong trình phản ứng sau: KI + KMnO4 + H2SO4 g I2 +... Số mol I2 tạo thành và số mol KI phản ứng là:
A. 0,00025 và 0,0005
B. 0,025 và 0,05
C. 0,25 và 0,5
D. 0,0025 và 0,005
Đáp án B
Bước đầu tiên, cần hoàn thành phương trình phản ứng với đầy đủ các chất và hệ số:
![]()
![]()
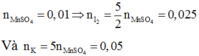
Nhận xét: Ngoài việc viết đầy đủ phản ứng như trên, các bạn vẫn có thể giải quyết bài toán bằng việc áp dụng định luật bảo toàn moi electron và bảo toàn nguyên tố:
Quá trình nhường electron:

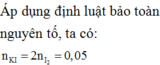
Hỗn hợp A gồm FeO, Fe2O3, Fe3O4 (trong đó số mol FeO bằng số mol Fe2O3). Hòa tan 4,64 gam A trong dung dịch H2SO4 loãng dư được 200 ml dung dịch X. Tính thể tích dung dịch KMnO4 0,1M cần thiết để chuẩn độ hết 100 ml dung dịch X?
A. 0,1l
B. 0,12l
C. 0,2l
D.0,24l
Đáp án C
Vì số mol của FeO bằng số mol của Fe2O3 nên ta coi hỗn hợp là Fe3O4
Ta có:
Fe3O4 +4H2SO4 → FeSO4 +Fe2(SO4)3 +4H2O
0,02 0,02
Trong 100 ml X sẽ có 0,01 mol FeSO4 nên:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
→ nKMnO4 = 0,02 mol → VKMnO4 = 0,02/0,1 = 0,2 l
Đốt cháy a mol sắt trong V lít oxi ( lấy due 10% so với lượng phản ứng) thu được 68.8 gam hỗn hợp 3 chất: FeO, Fe2O3, Fe3O4 có tỉ lệ về số mol lần lượt là 5:2:3. Để điều chế ra lượng oxi dư trong phản ứng trên cần m gam KMnO4 hoặc n gam KClO3
- Viết các ptpu
- Tính a, V, m, n