Cho 2,4g Kim loại R(II)tác dụng đủ vs 2,24l khí O2 (đktc) . Xác định tên kim loại R

Những câu hỏi liên quan
cho 6,5g kim loại R(hóa trị 2) tác dụng với hcl sinh ra 2,24l khí(đktc) xác định tên kim loại đó
\(R+2HCl\rightarrow RCl_2+H_2\\ n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\\ n_R=n_{H_2}=0,1\left(mol\right)\\ M_R=\dfrac{6,5}{0,1}=65\left(\dfrac{g}{mol}\right)\\ \Rightarrow R\left(II\right):Kẽm\left(Zn=65\right)\)
Đúng 3
Bình luận (0)
R+ 2HCl →RCl2 + H2
0,1 ← 0,1 mol
n H2 = 2,24:22,4=0,1 mol
n R =6,5/MR
=> 6,5/MR =0,1 => MR =65
=> R là kẽm (Zn)
Đúng 0
Bình luận (0)
Cho 3,6 g 1 kim loại R có hóa trị II tác dụng vs khí oxygen đun nóng sau phản ứng thu được 6g oxide. Xác định tên kim loại R
\(R+\dfrac{1}{2}O_2\rightarrow\left(t^o\right)RO\)
\(n_{RO}=\dfrac{6}{M_R+16}\)
\(R+\dfrac{1}{2}O_2\rightarrow\left(t^o\right)RO\)
\(\dfrac{6}{M_R+16}\) <---- \(\dfrac{6}{M_R+16}\) ( mol )
Ta có:
\(\dfrac{6}{M_R+16}.M_R=3,6\)
\(\Leftrightarrow6M_R=3,6M_R+57,6\)
\(\Leftrightarrow M_R=24\) ( g/mol )
=> R là Magie (Mg)
Đúng 3
Bình luận (2)
Áp dụng đlbtkl, ta có:
mR + mO2 = mR2On
=> mO2 = 6 - 3,6 = 2,4 (g)
nO2 = \(\dfrac{2,4}{32}=0,075\left(mol\right)\)
PTHH: 4R + nO2 ---to---> 2R2On
\(\dfrac{0,3}{n}\) 0,075
\(M_R=\dfrac{3,6}{\dfrac{0,3}{n}}=12n\left(\dfrac{g}{mol}\right)\)
Xét:
n = 1 => Loại
n = 2 => R = 24 => Mg
n = 3 => Loại
Vậy R là Mg
Đúng 2
Bình luận (0)
Cho 13,8 gam kim loại kiềm R tác dụng vs nc vừa đủ , thu đc 6,72 lít khí hidro ở đktc . Xác định kim loại R ( chiều em thi r mn ơi giúp em vs)
Vì R là kim loại kiềm nên R thuộc nhóm IA
\(n_{H_2}=\frac{6,72}{22,4}=0,3 (mol)\)
\(2R+H_2O->R_2O+H_2\)
0,6← 0,3 (mol)
⇒ \(M_R=\frac{m_R}{n_R}=\frac{13,8}{0,6}=23 (g/mol)\)
⇒ R là natri (Na)
Đúng 0
Bình luận (0)
cho 2,5g kim loại R ( hóa trị II) tác dụng với dung dịch H2SO4 loãng thấy giải phóng 2,24l ở đktc và tạo ra muối ( RSO4). Hãy xác định kim loại R
Tính được : \(n_{H2}=0,1\left(mol\right)\)
PTHH :
\(R+H_2SO_4\rightarrow RSO_4+H_2\)
\(1..1...........1........1\)
\(0,1......0,1..........0,1.........0,1\)
\(M_R=\frac{M_R}{M_R}=\frac{2,5}{0,1}=25\) ( g/mol )
Vậy \(R=25\)
Đúng 0
Bình luận (0)
R + H2SO4 ---> RSO4 + H2
nH2 = \(\dfrac{2,24}{22,4}\) = 0,1 mol
TPT : nR = nH2
=> nR = 0,1 mol
=> \(M_R\) = \(\dfrac{2,5}{0,1}\) = 25 đvC
Hình như sai đề bài
Đúng 0
Bình luận (0)
PƯHH:R+H2SO4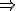 RSO4+H2
RSO4+H2
Ta có:nH2=2,24:22,4=0,1(mol)
Ta lại có:
1 mol R tạo thành 1 mol H2
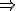 x mol R tạo thành 0,1 mol H2
x mol R tạo thành 0,1 mol H2
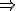 x=0,1(mol)
x=0,1(mol)
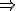 MR=mR:nR=2,5:0,1=25g
MR=mR:nR=2,5:0,1=25g
 không xác định
không xác định
Đúng 0
Bình luận (0)
Cho 8,1 (gam) kim loại R tác dụng vừa đủ với 10,08 (lít) khí Cl2 (đktc). Xác định kim loại R?
\(n_{Cl_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\)
PTHH: 2R + nCl2 --> 2RCln
\(\dfrac{0,9}{n}\)<--0,45
=> \(M_R=\dfrac{8,1}{\dfrac{0,9}{n}}=9n\left(g/mol\right)\)
Xét n = 1 => MR = 9 (Loại)
Xét n = 2 => MR = 18 (Loại)
Xét n = 3 => MR = 27 (Al)
Vậy R là Al
Đúng 7
Bình luận (0)
Cho 4,8 (gam) kim loại R tác dụng vừa đủ với 4,48 (lít) khí Cl2 (đktc). Xác định kim loại R?
cho 1,2g kim loại R có hóa trị II tác dụng với dd HCl dư, sau phản ứng thu đc 1,12lit H2(đktc).Xác định tên kim loại R?
\(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
PTHH: R + 2HCl --> RCl2 + H2
0,05<---------------0,05
=> \(M_R=\dfrac{1,2}{0,05}=24\left(g/mol\right)\)
=> R là Mg (Magie)
Đúng 4
Bình luận (1)
Cho 2,4g kim loại A tác dụng với dung dịch HCl 7,3% vừa đủ sau khi phản ứng kết thúc thu được 2,24l H2(ở đktc).
a)Xác định kim loại A
b)Tính nồng độ % chất tan trong dung dịch mới
\(n_{H_2}=\dfrac{2.24}{22.4}=0.1\left(mol\right)\)
\(2A+2nHCl\rightarrow2ACl_n+nH_2\)
\(\dfrac{0.2}{n}.......................0.1\)
\(M_A=\dfrac{2.4}{\dfrac{0.2}{n}}=12n\left(\dfrac{g}{mol}\right)\)
\(BL:n=2\Rightarrow M=24\)
\(A:Mg\)
\(m_{MgCl_2}=0.1\cdot95=9.5\left(g\right)\)
\(m_{ddHCl}=\dfrac{0.2\cdot36.5}{7.3\%}=100\left(g\right)\)
\(m_{dd}=2.4+100-0.1\cdot2=102.2\left(g\right)\)
\(C\%_{MgCl_2}=\dfrac{9.5}{102.2}\cdot100\%=9.3\%\)
Đúng 2
Bình luận (0)
cho 2,4g kim loại hóa trị II tác dụng với dung dịch HCl lấy dư, sau khi phản ứng kết thức thu được 2,24 lít khí H2 (ở đktc) xác định tên kim loại?
cho 2,7g kim loại hóa trị III tác dụng với dung dịch H2SO4 lấy dư, sau khi phản ứng kết thúc thu được 3,36 lí khia H2 (ở đktc) xác định tenn kim loại?
Bài 1 :
$R + 2HCl \to RCl_2 + H_2$
n R = n H2 = 2,24/22,4 = 0,1(mol)
M R = 2,4/0,1 = 24(Mg) - Magie
Bài 2 :
$2R + 6HCl \to 2RCl_3 + 3H_2$
n H2 = 3,36/22,4 = 0,15(mol)
n R = 2/3 n H2 = 0,1(mol)
M R = 2,7/0,1 = 27(Al) - Nhôm
Đúng 3
Bình luận (0)




























