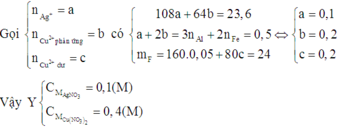Cho 100ml dung dịch Na2SO4 0,2M pư với 300ml dung dịch BaCl2 0,1M. Sau pư thu được dung dịch X và chất rắn Y
a) Tìm khối lượng chất rắn Y
b) Tìm CM các chất trong dung dịch X
Cho 100ml dung dịch BaCl2 0,1M vào 200ml dung dịch Na2SO4 0,05M. Tính
a. Khối lượng kết tủa thu được
b. Nồng độ mol của các chất trong dung dịch tạo thành
c. Nồng độ mol của các ion trong dung dịch sau phản ứng
a)
$BaCl_2 + Na_2SO_4 \to BaSO_4 + 2NaCl$
$n_{BaCl_2} = 0,01 = n_{Na_2SO_4} = 0,01 \Rightarrow $ Vừa đủ
$n_{BaSO_4} = n_{Na_2SO_4} = 0,01(mol)$
$m_{BaSO_4} = 0,01.233 = 0,233(gam)$
b)
$n_{NaCl} = 2n_{Na_2SO_4} = 0,02(mol)$
$V_{dd} = 0,1 + 0,2 = 0,3(lít)$
$C_{M_{NaCl}} = \dfrac{0,02}{0,3} = 0,067M$
c)
$[Na^+] = [Cl^-] = C_{M_{NaCl}} = 0,067M$
\(n_{BaCl_2}=0.1\cdot0.1=0.01\left(mol\right)\)
\(n_{Na_2SO_4}=0.2\cdot0.05=0.01\left(mol\right)\)
\(BaCl_2+Na_2SO_4\rightarrow BaSO_4+2NaCl\)
\(0.01..........0.01............0.01..............0.02\)
\(m_{BaSO_4}=0.01\cdot233=2.33\left(g\right)\)
\(C_{M_{NaCl}}=\dfrac{0.01}{0.1+0.2}=0.03\left(M\right)\)
\(\left[Na^+\right]=\left[Cl^-\right]=0.03\left(M\right)\)
Dung dịch X chứa H2SO4 0,2M và HCl 0,1M, dung dịch Y chứa KHCO3 0,3M và BaCl2 0,1M. Cho 0,5 lít dung dịch X phản ứng với 0,5 lít dung dịch Y và đun nóng, sau phản ứng hoàn toàn thấy tổng khối lượng các chất trong dung dịch thu được giảm m gam (giả sử nước bay hơi không đáng kể). Giá trị của m là
A. 18,25.
B. 22,65.
C. 11,65.
D. 10,34.
Đáp án A
Dung dịch X chứa H2SO4: 0,1 mol và HCl 0,05 mol; Y chứa KHCO3: 0,15 mol và BaCl2: 0,05 mol
Khối lượng dung dịch giảm chính bằng khối lượng chất rắn được hình thành và khí thoát ra
Þ BaSO4 (0,05 mol) và CO2 (0,15 mol) Þ m = 18,25 (g)
Cho m(g) dung dịch HCl 7,3% pư vừa đủ với 100(g) dung dịch Na2CO3 10, 6% sau pư, thu được dung dịch X cô cạn dung dịch X được a(g) muối khan.
a) Tìm m
b) Tìm a
c) Tìm C% các chất trong dung dịch X
Cho m(g) dung dịch HCl 7,3% pư vừa đủ với 100(g) dung dịch Na2CO3 10, 6% sau pư, thu được dung dịch X cô cạn dung dịch X được a(g) muối khan.
a) Tìm m
b) Tìm a
c) Tìm C% các chất trong dung dịch X
cho 1lit dung dịch chứa Na2CO3 0,1M và (NH4)2CO3 o,25M. cho 43g hỗn hợp BaCl2 và CaCl2 vào 1(lít) dung dịch hỗn hợp trên thu đc 39,7(g) kết tủa vào dung dịch B. chia B thành 2 phần bằng nhau:
phần 1: cho HCl dư vào sau đó cô cạn dung dịch, nung chất rắn thi đc rắn X. tính khối lượng rắn X?
phần 2: đung nóng rồi thêm từ từ 270ml dung dịch Ba(OH)2 0,2M. cô cạn dung dịch. Tính khối lượng rắn sau khi cô cạn
giúp mình với!
Pu tạo kết tủa BaCO3 và CaCO3
Ta thấy :khi thế 2 nguyên tử Cl bằng 1 nhóm CO3, khối lượng dung dịch giảm 35,5*2-60=11g
Mà khối lượng theo đầu bài giảm 43-39,7=3,3g>>n(BaCO3 và CaCO3)=3,3/11=0,3mol
Đặt nBaCO3=a;nCaCO3=B
>>Ta có hệ :197a+100b=39,7 và a+b=0,3>>a=0,1;b=0,2
>>%m BaCO3 =19,7/39,7*100=49,62%>>%CaCO3=50,38%
Cho m gam hỗn hợp X gồm Fe và Cu vào dung dịch H 2 S O 4 loãng, dư thu được 4,48 lít khí (đktc) và thấy còn 8,8 gam chất rắn không tan. Lấy phần chất rắn không tan ra thu được 250 ml dung dịch Y.
a. Xác định phần trăm về khối lượng các chất trong X.
b. Dung dịch Y tác dụng vừa đủ với B a C l 2 thu được 69,9 gam kết tủa. Tính nồng độ mol các chất trong Y.
c. Nếu cho 12 gam X vào 300 ml dung dịch A g N O 3 0,8M. Sau một thời gian thu được 28 gam chất rắn Z. Tính khối lượng của Ag có trong Z?
Cho 100 gam dung dịch BaCl2 10,4% vào 200 gam dung dịch H2SO49,8% sau phản ứng thu được chất rắn và dung dịch A.
a/ Tính khối lượng chất rắn.
b/ Tính nồng độ phần trămcác chất có trong dung dịch A.a
\(a,\left\{{}\begin{matrix}m_{BaCl_2}=\dfrac{100\cdot10,4\%}{100\%}=10,4\left(g\right)\\m_{H_2SO_4}=\dfrac{200\cdot9,8\%}{100\%}=19,6\left(g\right)\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}n_{BaCl_2}=\dfrac{10,4}{208}=0,05\left(mol\right)\\n_{H_2SO_4}=\dfrac{19,6}{98}=0,2\left(mol\right)\end{matrix}\right.\)
\(PTHH:BaCl_2+H_2SO_4\rightarrow BaSO_4\downarrow+2HCl\)
Vì \(\dfrac{n_{BaCl_2}}{1}< \dfrac{n_{H_2SO_4}}{2}\) nên \(H_2SO_4\) dư
\(\Rightarrow n_{BaSO_4}=n_{BaCl_2}=0,05\left(mol\right)\\ \Rightarrow m_{BaSO_4}=0,05\cdot233=11,65\left(g\right)\)
\(b,n_{HCl}=n_{BaSO_4}=0,05\left(mol\right)\\ \Rightarrow m_{CT_{HCl}}=0,05\cdot36,5=1,825\left(g\right)\\ \Rightarrow m_{dd_{HCl}}=100+200-11,65=288,35\left(g\right)\\ \Rightarrow C\%_{HCl}=\dfrac{1,825}{288,35}\cdot100\%\approx0,63\%\)
Trộn 200 gam dung dịch NaOH 10% vào 500ml dung dịch chứa H2SO4 0,2M và MgSO4 0,4M thu được dung dịch X và m1 g kết tủa. Lọc kết tủa đem nung đến khối lượng không đổi thu được m2 g chất rắn. Tính m1, m2 và CM các chất trong X, biết kiềm sẽ phản ứng với axit hết rồi sau đó mới tác dụng với muối.
mNaOH = 200.10% = 20 gam ➝ nNaOH = 0,5 mol
nH2SO4 = 0,1 mol, nMgSO4 = 0,2 mol
Phản ứng:
(1) 2NaOH + H2SO4 ➝ Na2SO4 + 2H2O
0,2 0,1 0,1 (mol)
(2) 2NaOH + MgSO4 ➝ Mg(OH)2 + Na2SO4
0,3 0,15 0,15 0,15 (mol)
Dung dịch X: Na2SO4: 0,25 mol, MgSO4 dư: 0,05 mol
Kết tủa Mg(OH)2: 0,15 mol
Mg(OH)2 ➝ MgO + H2O
0,15 0,15
m1 = 0,15.58 = 8,7 gam
m2 = 0,15.40 = 6 gam
Một hỗn hợp X gồm Al và Fe có khối lượng 8,3 gam. Cho X vào 1 lít dung dịch A chứa AgNO3 0,1M và Cu(NO3)2 0,2M. Sau khi phản ứng kết thúc được rắn B và dung dịch C đã mất màu hoàn toàn. B hoàn toàn không tan trong dung dịch HCl. Lấy 8,3 gam hỗn hợp X cho vào 1 lít dung dịch Y chứa AgNO3 và Cu(NO3)2 thu được chất rắn D có khối lượng là 23,6 gam và dung dịch E (màu xanh đã nhạt). Thêm NaOH dư vào dung dịch E được kết tủa. Đem kết tủa nung trong không khí đến khối lượng không đổi được 24 gam chất rắn F. Các phản ứng đều xảy ra hoàn toàn. Nồng độ mol của AgNO3 và Cu(NO3)2 trong dung dịch Y là:
A. 0,1M; 0,2M
B. 0,4M; 0,1M
C. 0,2M; 0,1M
D. 0,1M; 0,4M
Đáp án D
Vì dung dịch C đã mất màu hoàn toàn nên cả Ag+ và Cu2+ đều phản ứng hết.
Mà B không tan trong HCl nên B chỉ chứa Ag và Cu. Do đó cả Al và Fe đều phản ứng hết.
Suy ra cho X vào A thì cả 4 chất đều phản ứng vừa đủ.
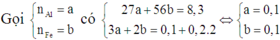
Vì dung dịch E đã nhạt màu nên Ag+ đã phản ứng hết và Cu2+ đã phản ứng một phần.
Do đó D chứa Ag và Cu.
Dung dịch E chứa Al3+, Fe2+ và Cu2+ dư. Khi đó E chứa Fe(OH)2 và Cu(OH)2
Suy ra F chứa Fe2O3 và CuO