Cần bn tấn CO để tham gia phản ứng với 160 Tấn \(Fe_2O_3\)?Bik sau phản ứng chỉ có sắt và CO2

Những câu hỏi liên quan
Cần bao nhiêu cacbon oxit tham gia phản ứng với 160 tấn Fe2O3 ? Biết rằng sau phản ứng có sắt và khí cacbonic tạo thành: A. 104 tấn B. 84 tấn C. 85 tấn D. 83,5 tấn
Ta có PTHH :
\(3CO+Fe2O3-^{t0}->2Fe+3CO2\)
84kg + 160kg-----------> 112kg
x kg+ 160000kg-------->112000kg
=> x = \(mCO\left(c\text{ần}\right)=\dfrac{160000.84}{160}=84000\left(kg\right)=84\left(t\text{ấn}\right)\)
vậy...........
Đúng 0
Bình luận (1)
Ta có PTHH :
3CO + Fe 2O3 - t0 - > 2Fe + 3CO2
84kg + 160kg -----------------> 112kg
xkg + 160000kg ----------- 112000kg
=> x = mCO( cân ) = \(\dfrac{160000.84}{160}=84000\left(kg\right)\)= 84 tấn
Vậy .......
Đúng 1
Bình luận (1)
đốt cháy hoàn toàn 25,2 gam sắt trong bình chứa khí O_2 tạo ra Fe_2O_3a.hãy viết phương trình phản ứng xảy rab.tính thể tích O_2(ở đktc) đã tham gia phản ứng trênc.tính khối lượng KCLO_3 cần dùng để khi phân hủy thì thu được một thể tích khí O_2(ở đktc) bằng với thể tích khí O_2 đã sử dụng ở phản ứng trên. biết sơ đồ pưph:KCLO_3rightarrow KCL+O_2
Đọc tiếp
đốt cháy hoàn toàn 25,2 gam sắt trong bình chứa khí \(O_2\) tạo ra \(Fe_2O_3\)
a.hãy viết phương trình phản ứng xảy ra
b.tính thể tích \(O_2\)(ở đktc) đã tham gia phản ứng trên
c.tính khối lượng \(KCLO_3\) cần dùng để khi phân hủy thì thu được một thể tích khí \(O_2\)(ở đktc) bằng với thể tích khí \(O_2\) đã sử dụng ở phản ứng trên. biết sơ đồ pưph:KCLO\(_3\)\(\rightarrow KCL+O_2\)
a) PTHH: 3Fe + 2O2---nhiệt độ--->Fe3O4
b) Số mol Fe: n = m/M =25,2/ 56 = 0,45 mol
số mol O2 theo PT: 0,45.2/3=0,3 mol
=> thể tích O2 (đktc) = n.22,4=0,3.22,4 = 6,72 lít
c) PTHH: 2KCLO3 ---nhiệt độ---> 2KCL+3O2
Số mol O2: n = V/22,4=6,72/22,4 = 0,3 mol
Số mol KCLO3 theo PT: n = 0,3.2/3 = 0,2 mol
=> khối lượng KCLO3=n.M=0,2.( 39+35,5+16.3)=24,5 gam
Đúng 3
Bình luận (0)
Bài 1: trong bình kín ko có không khí chứa bột hỗn hợp của 2,8g Fe và 3,2g S. Đốt nóng hỗn hợp cho phản ứng xảy ra hoàn toàn sau phản ứng thu được sắt(II) sunfua(FeS). Tính khối lượng FeS thu được sau phản ứng biết lưu huỳnh dư 1,6gBài 2:Fe3O4 là thành phần chính của quặng manhetit. Khi nung 232 tấn quặng manhetit thì cần 8 tấn khí hidro, sau phản ứng thu được sắt nguyên chất và 72 tấn hơi nước. Tính tỉ lệ phần trăm về khối lượng Fe3O4 trong quặng manhetit. Biết chỉ có Fe3O4 phản ứngbài 3: Có 1...
Đọc tiếp
Bài 1: trong bình kín ko có không khí chứa bột hỗn hợp của 2,8g Fe và 3,2g S. Đốt nóng hỗn hợp cho phản ứng xảy ra hoàn toàn sau phản ứng thu được sắt(II) sunfua(FeS). Tính khối lượng FeS thu được sau phản ứng biết lưu huỳnh dư 1,6g
Bài 2:Fe3O4 là thành phần chính của quặng manhetit. Khi nung 232 tấn quặng manhetit thì cần 8 tấn khí hidro, sau phản ứng thu được sắt nguyên chất và 72 tấn hơi nước. Tính tỉ lệ phần trăm về khối lượng Fe3O4 trong quặng manhetit. Biết chỉ có Fe3O4 phản ứng
bài 3: Có 1 viên đá vôi nhỏ, 1 ống nghiệm đựng axit clohidric và 1 cân nhỏ với độ chính xác cao. Làm thế nào để xác định được khối lượng khí cacbonic thoát ra khi cho viên đá vôi vào ống nghiệm đựng axit
giúp mình đi ạ, mình cần gấp lắm
Bài 1 :
Khối lượng FeS thu được sau phản ứng biết lưu huỳnh dư 1,6 g :
mFe = mFe + mS - mS.dư
= 2,8 + 3,2 - 1,6
= 4,4 (g)
Đúng 0
Bình luận (0)
a/Fe + S = FeS
2,8 +3,2= FeS
6 = FeS
=> FeS=6g
Đúng 0
Bình luận (1)
đổi 8 tấn = 8000000g
\(n_{H_2}=\dfrac{8000000}{2}=4000000\left(mol\right)\)
Fe3O4 + 4H2 \(\underrightarrow{t^o}\) 3Fe + 4H2O
de:1000000\(\leftarrow\) 4000000
\(m_{Fe_3O_4}=232.1000000=232000000g=232\left(t\right)\)
\(\%m_{Fe}=\dfrac{232}{232}.100\%=100\%\)
Đúng 0
Bình luận (0)
Người ta đốt sắt trong khí oxi, sau phản ứng thu được 6,96 gam oxit sắt từ (\(Fe_3O_4\)).
a. Viết phản ứng hóa học của phản ứng trên.
B. Tính khối lượng sắt đã tham gia phản ứng.
c. Tính thể tích oxi cần dùng (đktc).
d. Để có lượng oxi trên cần nhiệt phân ít nhất bao nhiêu gam \(KMnO_4\).
a)
\(b)n_{Fe_3O_4} = \dfrac{6,96}{232} = 0,03(mol)\\ 3Fe + 2O_2 \xrightarrow{t^o}Fe_3O_4\\ n_{Fe} = 3n_{Fe_3O_4} = 0,09(mol)\\ m_{Fe} = 0,09.56 = 5,04(gam)\\ c) n_{O_2} = 2n_{Fe_3O_4} = 0,06(mol)\\ V_{O_2} = 0,06.22,4 = 1,344(lít)\\ d) 2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 + O_2\\ n_{KMnO_4} = 2n_{O_2} = 0,12(mol)\\ m_{KMnO_4} = 0,12.158 = 18,96(gam)\)
Đúng 0
Bình luận (0)
\(n_{Fe_3O_4}=\dfrac{6.96}{232}=0.03\left(mol\right)\)
\(3Fe+2O_2\underrightarrow{t^0}Fe_2O_3\)
\(0.09.....0.06.......0.03\)
\(m_{Fe}=0.09\cdot56=5.04\left(g\right)\)
\(V_{O_2}=0.06\cdot22.4=1.344\left(l\right)\)
\(2KMnO_4\underrightarrow{t^0}K_2MnO_4+MnO_2+O_2\)
\(0.12...............................................0.06\)
\(m_{KMnO_4}=0.12\cdot158=18.96\left(g\right)\)
Đúng 0
Bình luận (0)
Người ta đốt sắt trong khí oxi, sau phản ứng thu được 13,92 gam oxit sắt từ (Fe3O4Fe3O4).
a. Viết phản ứng hóa học của phản ứng trên.
B. Tính khối lượng sắt đã tham gia phản ứng.
c. Tính thể tích oxi cần dùng (đktc).
d. Để có lượng oxi trên cần nhiệt phân ít nhất bao nhiêu gam KMnO4KMnO4.
n Fe3O4=\(\dfrac{13,92}{232}\)=0,06 mol
3Fe + 2O2 -to--> Fe3O4
0,18------0,12-------0,06
=>m Fe=0,18.56=10,08g
=>VO2=0,12.22,4=2,688l
2KMnO4-to>K2MnO4+MnO2+O2
0,24-------------------------------------0,12
=>m KMnO4=0,24.158=37,92g
Đúng 1
Bình luận (0)
nFe3O4 = 13,92 : 160= 0,087 (mol)
pthh : 3Fe + 2O2 -t--> Fe3O4
0,087->0,058-->0,029 (mol)
=> mFe = 0,029 . 56 = 1,624 (g)
=> VO2 = 0,058 . 22,4 = 1,2992 (L)
pthh : 2KMnO4 -t--> K2MnO4 + MnO2 + O2
0,116<------------------------------0,058 (mol)
=> mKMnO4 = 0,116 . 158 = 18,328 (g)
Đúng 0
Bình luận (1)
Đốt cháy 4,5 gam este X cần 7,056 lít oxi (đktc), chỉ sinh ra CO2 và H2O với tỉ lệ số mol
C
O
2
/
H
2
O
1,8. Nếu đun nóng 0,2 mol X với dung dịch NaOH thấy 0,4 mol NaOH tham gia phản ứng. X không có chức ete, không phản ứng với Na trong điều kiện bình thường và không khử được AgNO3/NH3 ngay cả khi đun nóng. Biết Mx 160 đvC. Công thức cấu tạo của X có thể là? A. HCOOC6H5 B. CH3COOC6H5 C. C2H...
Đọc tiếp
Đốt cháy 4,5 gam este X cần 7,056 lít oxi (đktc), chỉ sinh ra CO2 và H2O với tỉ lệ số mol C O 2 / H 2 O = 1,8. Nếu đun nóng 0,2 mol X với dung dịch NaOH thấy 0,4 mol NaOH tham gia phản ứng. X không có chức ete, không phản ứng với Na trong điều kiện bình thường và không khử được AgNO3/NH3 ngay cả khi đun nóng. Biết Mx < 160 đvC. Công thức cấu tạo của X có thể là?
A. HCOOC6H5
B. CH3COOC6H5
C. C2H5COOC6H5
D. C2H3COOC6H5
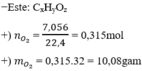
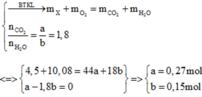
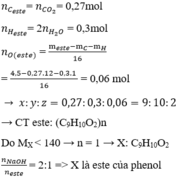
X không có chức ete, không phản ứng với Na trong điều kiện bình thường và không khử được AgNO3, trong amoniac ngay cả khi đun nóng
=> X có CTCT là: CH3COOC6H4CH3 hoặc C2H5COOC6H5
Đáp án cần chọn là: C
Đúng 0
Bình luận (0)
Cho sơ đồ phản ứng :
Fe3O4 + CO -> Fe + CO2
a) Cân bằng phương trình hóa học trên
b) Nếu sau phản ứng thu được 6,72 lít CO2 ở đktc hãy tính :
- Khối lượng và số phân tử của các chất tham gia phản ứng
- khối lượng của sắt tạo thành
nCO2=V/22,4=6,72/22,4=0,3(mol)
a/ PTHH: Fe3O4 +4CO = 3Fe+4CO2
Theo phản ứng: 1 : 4 : 3 : 4 (mol)
Theo bài ra: 0,075 0,3 0,225 0,3 (mol)
mFe3O4 = n.M=0,075.232=17,4(g)
mCO = n.M=0,3.28=8,4(g)
Phân tử của Fe3O4 là: n.6.1023 =0,075.6.1023 =0,45.1023 (phân tử)
Phân tử của CO là: n.6.1023 =0,3.6.1023 =1,8.1023 ( phân tử)
mFe = n.M=0,225.56=12,6(g)
hok tốt
Cho sơ đồ phản ứng :
Fe3O4 + CO -> Fe + CO2
a) Cân bằng phương trình hóa học trên
b) Nếu sau phản ứng thu được 6,72 lít CO2 ở đktc hãy tính :
- Khối lượng và số phân tử của các chất tham gia phản ứng
- khối lượng của sắt tạo thành
Để sản xuất sắt, người ta đưa vào lò 250 tấn quặng hematit có chứa 60% Fe2O3, còn lại là tạp chất rắn không phản ứng rồi khử bằng khí CO. Tính khối lượng sắt thu được biết hiệu suất của nó chỉ đạt 90%.
Mình cần gấp lắm, giúp mình với
K/lượng của Fe2O3 nguyên chất trong 250 tấn quặng hematit là :
250.60%=150(tấn)
=150000000(g)
Fe2O3+3CO-->2Fe+3CO2
Số mol của Fe2O3 là:
n=m/M=150000000:160
=937500(mol)
Số mol của Fe là:
nFe=2nFe2O3=2.937500
=1875000(mol)
K/lượng của Fe là:
m=n.M=1875000.56
=105000000(g)
K/lượng của Fe nếu hiệu suất chỉ đạt 90% là:
105000000.90%
=94500000(g)
=94,5 tấn
Mình không biết là đúng hay sai nha
Đúng 0
Bình luận (1)






























