Hòa tan hoàn toàn 13 gam kim loại M trong 300 ml dung dịch H2SO4 1M ( loãng ) thấy có khí thoát ra . Để trung hòa lượng axit dư cần dùng 200 ml dung dịch NaOH 1M . Xác định M ?
Hòa tan hoàn toàn 24 gam một kim loại hóa trị 2 trong 750 ml H2SO4 1M. Để trung hòa axit dư trong dung dịch thu được phải dùng hết 150 ml dung dịch NaOH 2M. xác định kim loại
\(n_{NaOH} = 0,15.2 = 0,3(mol)\\ 2NaOH + H_2SO_4 \to Na_2SO_4 + 2H_2O\\ n_{H_2SO_4\ dư} = \dfrac{1}{2}n_{NaOH} = 0,15(mol)\\ n_{H_2SO_4\ pư} = 0,75 - 0,15 = 0,6(mol)\\ \)
Gọi kim loại cần tìm là R
\(R + H_2SO_4 \to RSO_4 + H_2\\ n_R = n_{H_2SO_4} = 0,6(mol)\\ \Rightarrow M_R = \dfrac{24}{0,6} =40(Ca)\)
Vậy kim loại cần tìm là Canxi
Hòa tan hoàn toàn 1,44 gam kim loại hóa trị II trong 200 ml dung dịch H2SO4 0,5M. Để trung hòa lượng axit dư phải dùng hết 80 ml dung dịch KOH 1M. Kim loại cần tìm là
A. Magie
B. Canxi
C. Bari
D. Beri
Hòa tan hoàn toàn 1,44 gam kim loại hóa trị II trong 200 mL dung dịch H2SO4 0,5M. Để trung hòa lượng axit dư phải dùng hết 80 mL dung dịch KOH 1M. Kim loại cần tìm là
A. Magie.
B. Canxi.
C. Bari.
D. Beri.
Hòa tan hoàn toàn 1,44 gam kim loại hóa trị II trong 200 mL dung dịch H2SO4 0,5M. Để trung hòa lượng axit dư phải dùng hết 80 mL dung dịch KOH 1M. Kim loại cần tìm là
A. Magie.
B. Canxi.
C. Bari.
D. Beri.
Đáp án A
M + H2SO4 → MSO4 + H2 (1)
2KOH + H2SO4 → K2SO4 + 2H2O (2)
![]()
Mà
![]()
![]()
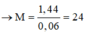
M là Magie
Hòa tan hoàn toàn 8,4 gam kim loại R (hóa trị không đổi) vào 200 ml dung dịch HCl 2,5M. Để trung hòa lượng axit dư sau phản ứng phải dùng 80gam dung dịch NaOH 10%
a) Xác định kim loại R
b) Trộn 2,1 gam MgCO3 và 8,4 gam R trên rồi cho tác dụng với H2SO4 đặc, nóng, dư thì thu được V lít hỗn hợp 2 khí (ở đktc) có tỉ khối so với H2 bằng 31. Xác định V
Hòa tan hoàn toàn m gam KMnO4 trong dung dịch HCl đặc (dư), thu được dung dịch X và V lít khí Z (đktc). Pha loãng dung dịch X thu được 500 ml dung dịch Y.
- Để trung hòa axit dư trong 50 ml dung dịch Y cần dùng vừa đủ 24 ml dung dịch NaOH 0,5 M.
- Cho dung dịch AgNO3 dư vào 100 ml dung dịch Y để kết tủa hoàn toàn ion clorua thu được 17,22 gam kết tủa.
1. Viết phương trình hóa học của các phản ứng xảy ra.
2. Tính nồng độ mol/lít của các chất tan trong Y.
3. Tính m, V và thể tích dung dịch HCl 36,5% (d = 1,18 g/ml) đã dùng.
GIÚP MÌNH VỚI MÌNH ĐANG CẦN GẤP
Câu 7. Hoà tan 1,3 gam một kim loại M trong 100 ml dung dịch H2SO4 0,3M. Để trung hoà lượng axit dư cần 200 ml dung dịch NaOH 0,1M. Xác định kim loại M?
Hòa tan hoàn toàn 11,2 gam một kim loại R bằng dung dịch H2SO4, thu được khí SO2. Cho toàn bộ lượng khí này hấp thụ hết vào 400 ml dung dịch NaOH 1M, thu được dung dịch chứa 33,4 gam chất tan. Mặt khác, hòa tan hoàn toàn 19,6 gam kim loại R vào 160 ml dung dịch HCl 2M thu được dung dịch X. Cho X tác dụng với dung dịch AgNO3 dư, thu được m gam kết tủa. Giá trị của m là
A. 57,8.
B. 45,92.
C. 54,6
D. 83,72
Bài 7: Hỗn hợp gồm một kim loại kiềm (hóa trị I) và oxit của nó có khối lượng 19,3 gam tan hết trong nước thoát ra 3,36 lít H2 (đktc) và thu được một dung dịch kiềm. Để trung hòa dung dịch kiềm này cần dùng hết 350 ml H2SO4 1M. Xác định kim loại kiềm.
Bài 8: Một hỗn hợp gồm Zn và Fe có khối lượng là 30,7 gam. Hòa tan hỗn hợp này trong 400 ml dung dịch H2SO4 2M.
a/ Chứng tỏ rằng hỗn hợp này tan hết.
b/ Nếu dùng một lượng hỗn hợp Zn và Fe gấp đôi trường hợp trước, lượng H2SO4 vẫn như cũ thì hỗn hợp mới này có tan hết hay không?
c/ Trong trường hợp (a), hãy tính khối lượng mỗi kim loại trong hỗn hợp biết rằng khi đốt cháy lượng H2 sinh ra trong phản ứng, thì thu được 8,1 gam nước (lượng nước bị hao hụt 10%).