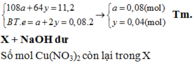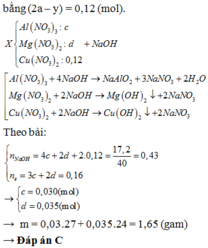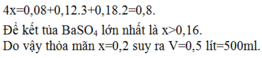cho hỗn hợp A gồm Mg và Al vào 500ml dung dịch X gồm HCl và H2SO4 được dd B và 3,92 lít H2 ở đktc.Thể tích dd D gồm NaOH 0,2M và Ba(OH02 0,1M cần phải phản ứng hết với các chất trong B?

Những câu hỏi liên quan
Cho m gam hỗn hợp gồm Al và Mg tác dụng với V lít dung dịch gồm
A
g
N
O
3
0,1M và
C
u
N
O
3
2
0,2M thu được dung dịch X và 11,2 gam chất rắn Y. Cho Y tác dụng với dung dịch
H
2
S
O
4
đặc, nóng...
Đọc tiếp
Cho m gam hỗn hợp gồm Al và Mg tác dụng với V lít dung dịch gồm A g N O 3 0,1M và C u N O 3 2 0,2M thu được dung dịch X và 11,2 gam chất rắn Y. Cho Y tác dụng với dung dịch H 2 S O 4 đặc, nóng (dư), thu được 1,792 lít khí S O 2 (ở đktc, là sản phẩm khử duy nhất). Cho dung dịch NaOH dư vào X thì có 17,2 gam NaOH phản ứng. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
A. 1,74
B. 1,56
C. 1,65
D. 1,47
Hấp thụ hoàn toàn 4,48l khí CO2 vào 500ml dd hỗn hợp gồm NaOH 0,1M và Ba(OH)2 0,2M, sau phản ứng thu được m gam kết tủa và dd X
a) Tính giá trị m
b) Tính tổng khối lượng các chất tan có trong dd X
nCO2=0,2mol;
nNaOH=0,5.0,1=0,05mol;
nBa(OH)2=0,5.0,2=0,1mol
→nOH−=nNaOH+2nBa(OH)2=0,05+2.0,1=0,25mol
Do 2.nCO2>nOH−>nCO2→ Có kết tủa
→nCO32-=nOH−−nCO2=0,25−0,2=0,05mol<nBa2+
→nBaCO3=nCO3−2=0,05mol→mBaCO3=0,05.197=9,85gam
Đúng 1
Bình luận (0)
Trộn 2 dd H2SO4 2M với HCl 1,5M với nhau theo tỉ lệ thể tích 1:1 thu được dd X. Hoà tan hoàn toàn 5,1g hỗn hợp Y gồm Mg và Al trong 200ml dd X thu được 5,6 lít H2 (đktc) và dung dịch Z. a. CMR : dd Z còn dư axit b. Cho 300ml dd B gồm Ba(OH)2 0,6M và NaOH 1M vào dd Z. Tính khối lượng kết tủa thu được sau phản ứng.
Theo gt ta có: $n_{H_2SO_4}=0,2(mol);n_{HCl}=0,15(mol);n_{H_2}=0,25(mol)$
a, Bảo toàn H ta có: $n_{H^+/pu}=0,5(mol)< 0,55(mol)$
Do đó axit còn dư
b, Ta có: $n_{Ba(OH)_2}=0,18(mol);n_{NaOH}=0,3(mol)$
Gọi số mol Mg và Al lần lượt là a;b(mol)
$\Rightarrow 24a+27b=5,1$
Bảo toàn e ta có: $2a+3b=0,5$
Giải hệ ta được $a=b=0,1$
Lượng $OH^-$ tạo kết tủa là $0,18.2+0,3-0,05=0,61(mol)$
Kết tủa gồm 0,18 mol $BaSO_4$; 0,1 mol $Mg(OH)_2$ (Do Al(OH)3 tạo ra bị hòa tan hết)
$\Rightarrow m_{kt}=47,74(g)$
Đúng 2
Bình luận (0)
Hòa tan hết hỗn hợp gồm Mg và Al trong dung dịch chứa H2SO4 0,2M và HCl 0,6M. Sau khi kết thúc phản ứng, thu được dung dịch X và 8,064 lít khí H2. Cho dung dịch NaOH 1M đến dư vào dung dịch X, phản ứng được biểu diễn theo đồ thị sau: Nếu cho từ từ V ml dung dịch Ba(OH)2 0,4M và NaOH 0,8M vào dung dịch X, thu được kết tủa lớn nhất. Giá trị của V là A. 300 ml B. 500 ml C. 200 ml D. 400 ml
Đọc tiếp
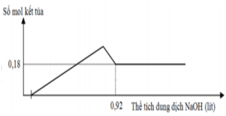
Hòa tan hết hỗn hợp gồm Mg và Al trong dung dịch chứa H2SO4 0,2M và HCl 0,6M. Sau khi kết thúc phản ứng, thu được dung dịch X và 8,064 lít khí H2. Cho dung dịch NaOH 1M đến dư vào dung dịch X, phản ứng được biểu diễn theo đồ thị sau:
Nếu cho từ từ V ml dung dịch Ba(OH)2 0,4M và NaOH 0,8M vào dung dịch X, thu được kết tủa lớn nhất. Giá trị của V là
A. 300 ml
B. 500 ml
C. 200 ml
D. 400 ml
Đáp án B
![]()
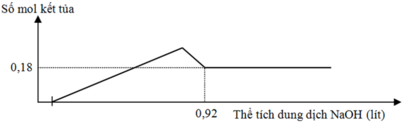
Đồ thị trải qua các giai đoạn:
+Chưa xuất hiện kết tủa do NaOH trung hòa axit dư.
+Kết tủa tăng dần.
+Kết tủa giảm dần do NaOH hòa tan Al(OH)3, kết tủa sau cùng chỉ còn lại là Mg(OH)2.
Nhận thấy lúc 0,92 mol NaOH phản ứng thì kết tủa thu được là 0,18 mol Mg(OH)2
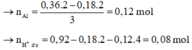
Giải được số mol H2SO4 0,16 mol, HCl 0,48 mol.
Cho V ml Ba(OH)2 0,4M và NaOH 0,8M chứa x mol Ba(OH)2 và 2x mol NaOH.
Để kết tủa hidroxit lớn nhất là 4x=0,08+0,12.3+0,18.2=0,8.
Để kết tủa BaSO4 lớn nhất là x>0,16.
Do vậy thỏa mãn x=0,2 suy ra V=0,5 lít=500ml.
Đúng 0
Bình luận (0)
Hòa tan hết hỗn hợp gồm Mg và Al trong dung dịch chứa H2SO4 0,2M và HCl 0,6M. Sau khi kết thúc phản ứng, thu được dung dịch X và 8,064 lít khí H2. Cho dung dịch NaOH 1M đến dư vào dung dịch X, phản ứng được biểu diễn theo đồ thị sau Nếu cho từ từ V ml dung dịch Ba(OH)2 0,4M và NaOH 0,8M vào dung dịch X, thu được kết tủa lớn nhất. Giá trị của V là
Đọc tiếp
Hòa tan hết hỗn hợp gồm Mg và Al trong dung dịch chứa H2SO4 0,2M và HCl 0,6M. Sau khi kết thúc phản ứng, thu được dung dịch X và 8,064 lít khí H2. Cho dung dịch NaOH 1M đến dư vào dung dịch X, phản ứng được biểu diễn theo đồ thị sau
Nếu cho từ từ V ml dung dịch Ba(OH)2 0,4M và NaOH 0,8M vào dung dịch X, thu được kết tủa lớn nhất. Giá trị của V là
![]()
![]()
![]()
![]()
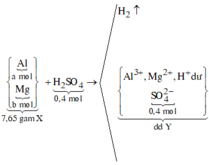
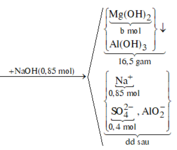
Cho 7,65 gam hỗn hợp X gồm Al và Mg tan hoàn toàn trong 500ml dung dịch H2SO4 0,8M, thu được dung dịch Y và khí H2, Cho 850ml dung dịch gồm NaOH 1M vào Y, sau khi các phản ứng xảy ra hoàn toàn thu được 16,5 gam kết tủa gồm 2 chất. Phần trăm số mol của Al trong X là:
A. 50,00%.
B. 25,00%.
C. 52,94%.
D. 47,06%.
Số mol các chất là: ![]()
![]()
Đặt số mol các chất trong X là Al: a mol; Mg: b mol.
![]()
Sơ đồ phản ứng:
![]()
![]()
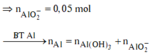
![]()
![]()
![]()
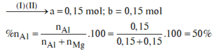
Đáp án A
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn m gam hỗn hợp X gồm Al và Al2O3 trong 500ml dung dịch chứa hỗn hợp NaOH 0,3M và Ba(OH)2 0,1M thu được dung dịch Y và 3,36 lít H2 (đktc). Cho dung dịch Y phản ứng với 500 ml dung dịch Z chứa HCl 0,64M và H2SO4 0,08M thu được 21,02 gam kết tủa. Nếu cho dung dịch Y phản ứng với V lít dung dịch Z thì thu được kết tủa lớn nhất có khối lượng a gam. Giá trị của a là: A. 20,750 B. 21,425 C. 31,150 D. 21,800
Đọc tiếp
Hòa tan hoàn toàn m gam hỗn hợp X gồm Al và Al2O3 trong 500ml dung dịch chứa hỗn hợp NaOH 0,3M và Ba(OH)2 0,1M thu được dung dịch Y và 3,36 lít H2 (đktc). Cho dung dịch Y phản ứng với 500 ml dung dịch Z chứa HCl 0,64M và H2SO4 0,08M thu được 21,02 gam kết tủa. Nếu cho dung dịch Y phản ứng với V lít dung dịch Z thì thu được kết tủa lớn nhất có khối lượng a gam. Giá trị của a là:
A. 20,750
B. 21,425
C. 31,150
D. 21,800
Đáp án B
Ta có: nNaOH = 0,15 mol; nBa(OH)2 = 0,05 mol
Dung dịch Y chứa 0,15 mol Na+, 0,05 mol Ba2+, u mol AlO2- và v mol OH- dư
Định luật bảo toàn điện tích ta có u + v = 0,15 + 0,05.2 = 0,25 (1)
Ta có: nHCl = 0,32 mol và nH2SO4 = 0,04 mol→ nH+ = 0,4 mol; nSO4(2-) = 0,04 mol
→ nBaSO4 = 0,04 mol
Ta có: mkết tủa = 21,02 gam → nAl(OH)3 = 0,15 mol
Nếu Al(OH)3 chưa bị hòa tan thì nH+ = 0,4 = v + 0,15 (2)
Nếu Al(OH)3 đã bị hòa tan thì nH+ = 0,4 = v + 4u - 3.0,15 (3)
Giải hệ (1) và (2) ra vô nghiệm
Giải hệ (1) và (3) ra u = 0,2 và v = 0,05
Vậy Y gồm Na+ 0,15 mol; 0,05 mol Ba2+; 0,2 mol AlO2- và OH- dư (0,05 mol)
V lít dung dịch Z gồm 0,64V mol HCl và 0,08V mol H2SO4
→ nH+ = 0,8V mol và nSO4(2-) = 0,08 V mol
Khi Al(OH)3 max thì 0,8V = u+ v suy ra V = 0,3125
Suy ra nBaSO4 = 0,025 mol → mkết tủa = 21,425 gam
Khi BaSO4 max thì 0,08V = 0,05 suy ra V = 0,625
Suy ra nH+ = 0,8V = v + 4u-3.nAl(OH)3 → nAl(OH)3 = 7/60 mol → mkết tủa = 20,75 gam
Vậy mkết tủa max = 21,425 gam
Đúng 0
Bình luận (0)
Cho 14g hỗn hợp X gồm Zn,Mg,Al ở dạng bột,nung nóng tác dụng vừa đủ với khi oxi thu được 21,2g hỗn hợp Y gồm các oxit. Thể tích dd hỗn hợp Z gồm HCl 0,1M và H2SO4 0,1M vừa đủ phản ứng với 21,2g Y là?
\(n_O=\dfrac{21,2-14}{16}=0,45\left(mol\right)\)
=> nH2O = 0,45 (mol)
Giả sử có V (lít) dd Z
=> \(\left\{{}\begin{matrix}n_{HCl}=0,1V\left(mol\right)\\n_{H_2SO_4}=0,1V\left(mol\right)\end{matrix}\right.\)
Bảo toàn H: 0,1V + 2.0,1V = 0,45.2
=> V = 3 (lít)
Đúng 4
Bình luận (0)
Dung dịch X chứa H2SO4 0,4M với HCl 0,5M. Cho 6,85g hỗn hợp A gồm Mg và Zn vào 500ml dd X khuấy đều cho các phản ứng xảy ra hoàn toàn. Thêm tiếp dd Ba(OH)2 dư vào thu được kết tủa B, lọc lấy kết tủa B đem nung ở nhiệt độ cao đến khối lượng không đổi thu được 52,6g chất rắn. Biết rằng BaSO4 không bị nhiệt phân.
a. Viết phương trình phản ứng xảy ra.
b. Tính khối lượng các kim loại trong hỗn hợp A.
Đọc tiếp
Dung dịch X chứa H2SO4 0,4M với HCl 0,5M. Cho 6,85g hỗn hợp A gồm Mg và Zn vào 500ml dd X khuấy đều cho các phản ứng xảy ra hoàn toàn. Thêm tiếp dd Ba(OH)2 dư vào thu được kết tủa B, lọc lấy kết tủa B đem nung ở nhiệt độ cao đến khối lượng không đổi thu được 52,6g chất rắn. Biết rằng BaSO4 không bị nhiệt phân. a. Viết phương trình phản ứng xảy ra. b. Tính khối lượng các kim loại trong hỗn hợp A.
Ba(OH)2 dư => Zn(OH)2 tan hết , kết tủa chỉ là Mg(OH)2.
\(n_{Mg}=n_{MgO}=\dfrac{52.6}{40}=1.315\left(g\right)\)
\(m_{Mg}=1.315\cdot24=31.56\left(g\right)>m_{hh}\)
Đề sai !
Đúng 1
Bình luận (0)
a)H2SO4 + Zn --> ZnSO4 + H2
HCl + Zn --> ZnCl2 + H2
H2SO4 + Mg --> MgSO4 + H2
HCl + Mg --> MgCl2 + H2
Zn + H2O --> Zn(OH)2+ H2
Mg + H2O --> Mg(OH)2 + H2
Zn(OH)2 + Mg(OH)2 --> MgZnO2 + H2O
Đúng 1
Bình luận (0)