Trong phòng thí nghiệm người ta dùng 5,6 g khí CO để thử oxit sắt từ Fe3O4 thu được sắt và khis Cacbonic
a.viết PTHH
b.tính số lượng sắt thu được
c.tính thể tích khí cacbonic ở đktc
d.tính thể tích khí cacbonic cần dùng cho phản ứng
Trong phòng thí nghiệm người ta dùng hiđro để khử sắt (III) oxi và thu được 12,6 g sắt.
a. Tính khối lượng sắt (III) oxit đã phản ứng;
b. Tính thể tích khí hiđro đã tiêu thụ (ở đktc).
Fe2O3+3H2-to>2Fe+3H2O
0,1125---0,3375----0,225 mol
n Fe=0,225 mol
=>m Fe2O3=0,1125.160=18g
=>VH2=0,3375.22,4=7,56l
a,\(n_{Fe}=\dfrac{12,6}{56}=0,225\left(mol\right)\)
PTHH: 3H2 + Fe2O3 ---to---> 2Fe + 3H2O
Mol: 0,3375 0,1125
\(m_{Fe_2O_3}=0,1125.160=18\left(g\right)\)
b, \(V0,3375.22,4=7,56\left(l\right)\)
trong phòng thí nghiệm, ngta dùng khí H2 để khử sắt (III) oxit (Fe2O3) và thu đc 22,4 g sắt (Fe) và nước (H2O)
a) tính khối lượng sắt (III) oxit đã phản ứng?
b) tính thể tích khí hidro đã sử dụng
c) để điều chế lượng khí hidro trên, người ta dùng kim loại kẽm (Zn) cho phản ứng với dung dịch axit sunfuric (H2SO4) . tính khối lượng kim loại kẽm cần dùng
PTHH: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
a+b) \(n_{Fe}=\dfrac{22,4}{56}=0,4\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{Fe_2O_3}=0,2\left(mol\right)\\n_{H_2}=0,6\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Fe_2O_3}=0,2\cdot160=32\left(g\right)\\V_{H_2}=0,6\cdot22,4=13,44\left(l\right)\end{matrix}\right.\)
c) PTHH: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\uparrow\)
Theo PTHH: \(n_{Zn}=n_{H_2}=0,6\left(mol\right)\)
\(\Rightarrow m_{Zn}=0,6\cdot65=39\left(g\right)\)
a,
nFe = 22,4/56 = 0,4 (mol)
PTHH
Fe2O3 + 3H2 ---to----) 2Fe + 3H2O (1)
theo phương trình (1) ,ta có:
nFe2O3 = 0,4 x 2 / 1 = 0,8 (mol)
mFe2O3 = 160 x 0,8 = 128 (g)
b,
theo pt (1)
nH2 = (0,4 x 3)/2 = 0,6 (mol)
=) VH2 = 0,6 x 22,4 = 13,44 (L)
c,
PTHH
Zn + H2SO4 -------------) ZnSO4 + H2 (2)
Số mol H2 cần dùng là 0,6 (mol)
Theo PT (2) :
nZn = nH2 ==) nZn = 0,6 x 65 = 39 (g)
trong phòng thí nghiệm người ta dùng khí H2 để khử sắt III oxit và thu đc 11.2 g sắt
a, viết phương trình hóa học của phản ứng xảy ra.
b, Tính khối lượng sắt III oxit đã phản ứng
c, tính thể tích khí H2 đã tiêu thụ ở dktc
nFe=0,2(mol)
a) PTHH: Fe2O3 + 3 H2 -to-> 2 Fe + 3 H2O
0,1_____________0,3____0,2(mol)
b) mFe2O3=160.0,1=16(g)
c) V(H2,đktc)=0,3.22,4=6,72(l)
nFe = 11.2/56 = 0.2 (mol)
FeO + H2 -to-> Fe + H2O
0.2.....0.2...........0.2
mFeO = 0.2*72 = 14.4 (g)
VH2 = 0.2*22.4 = 4.48 (l)
Trong phòng thí nghiệm người ta oxi hóa sắc ở nhiệt độ cao thu được 23,2gam oxit sắt từ(Fe3O4) a) tính khối lượng sắt cần cho phản ứng oxi hóa b) tính thể tích khí oxi cần cho phản ứng
a, \(n_{Fe_3O_4}=\dfrac{23,2}{232}=0,1\left(mol\right)\)
PT: \(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
Theo PT: \(n_{Fe}=3n_{Fe_3O_4}=0,3\left(mol\right)\Rightarrow m_{Fe}=0,3.56=16,8\left(g\right)\)
b, \(n_{O_2}=2n_{Fe_3O_4}=0,2\left(mol\right)\Rightarrow V_{O_2}=0,2.22,4=4,48\left(l\right)\)
\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
0,3 0,2 0,1
\(n_{Fe_3O_4}=\dfrac{23,2}{232}=0,1\left(mol\right)\)
\(a,m_{Fe}=0,3.56=16,8\left(g\right)\)
\(b,V_{O_2}=0,2.22,4=4,48\left(l\right)\)
\(a)n_{Fe_3O_4}=\dfrac{23,2}{232}=0,1\left(mol\right)\\ PTHH:3Fe+2O_2\xrightarrow[t^0]{}Fe_3O_4\\ n_{Fe}=0,1.3=0,3\left(mol\right)\\ m_{Fe}=0,3.56=16,8\left(g\right)\\ b)n_{O_2}=0,1.2=0,2\left(mol\right)\\ V_{O_2}=0,2.22,4=4,48\left(l\right)\)
:Trong phòng thí nghiệm người ta dùng khí hiđro để khử sắt(III) oxit và thu được 11,2 gam Fe. a) Viết phương trình hóa học của phản ứng đã xảy ra.
b) Tính khối lượng sắt(III) oxit đã phản ứng.
c) Tính thể tích khí hiđro đã tiêu thụ (ở đktc).
a, \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
b, \(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
Theo PT: \(n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe}=0,1\left(mol\right)\Rightarrow m_{Fe_2O_3}=0,1.160=16\left(g\right)\)
c, Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Fe}=0,3\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,3.22,4=6,72\left(l\right)\)
Trong phòng thí nghiệm, người ta dùng hidro để khử sắt (III) oxit và thu được 11,2 gam sắt.
Viết phương trình hoá học của phản ứng đã xảy ra.
Tính khối lượng sắt(III) oxit đã phản ứng.
Tính thể tích khí hidro đã tiêu thụ (ở đktc).
Trong phòng thí nghiệm người ta dùng khí hiđro để khử sắt(II) oxit và thu được 11,2 g Fe.
a) Viết phương trình hóa học của phản ứng đã xảy ra.
b) Tính khối lượng sắt (III) oxit đã phản ứng.
c) Tính thể tích khí hiđro đã tiêu thụ (đktc).
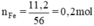
Phương trình hóa học của phản ứng:
Fe2O3 + 3H2 → 2Fe + 3H2O.
Khử 1 mol Fe2O3 cho 2 mol Fe.
x mol Fe2O3 → 0,2 mol.
x = 0,2 : 2 =0,1 mol.
m = 0,1 .160 =16g.
Khử 1 mol Fe2O3 cần 3 mol H2.
Vậy khử 0,1 mol Fe2O3 cần 0,3 mol H2.
V= 0,3 .22.4 = 6,72l.
Trong phòng thí nghiệm, người ta dùng hidro để khử 20g Sắt(III) Oxit có chứa 20% tạp chất.
a) Tính khối lượng của Sắt tạo thành
b) Tính thể tích khí H2 thu được (đktc) cần dùng.
\(m_{Fe_2O_3}=20.\left(100\%-20\%\right)=16\left(g\right)\\ \rightarrow n_{Fe_2O_3}=\dfrac{16}{160}=0,1\left(mol\right)\)
PTHH: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
0,1--->0,3------------>0,2
=> \(\left\{{}\begin{matrix}m_{Fe}=0,2.56=11,2\left(g\right)\\V_{H_2}=0,3.22,4=6,72\left(l\right)\end{matrix}\right.\)
\(m_{Fe_2O_3}=20.80\%=16g\\ n_{Fe_2O_3}=\dfrac{16}{160}=0,1\left(mol\right)\\ pthh:Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3O_2\)
0,1 0,3 0,2
\(V_{H_2}=0,3.22,4=6,72\left(L\right)\\ m_{Fe}=0,2.56=11,2\left(g\right)\)
Trong phòng thí nghiệm, người ta dùng hiđro để khử sắt(III) oxit và thu được 11,2 gam sắt.
Viết phản ứng hóa học xảy ra.
Tính khối lượng sắt(III) oxit đã phản ứng.
Tính thể tích khí hiđro đã tiêu thụ (đktc).