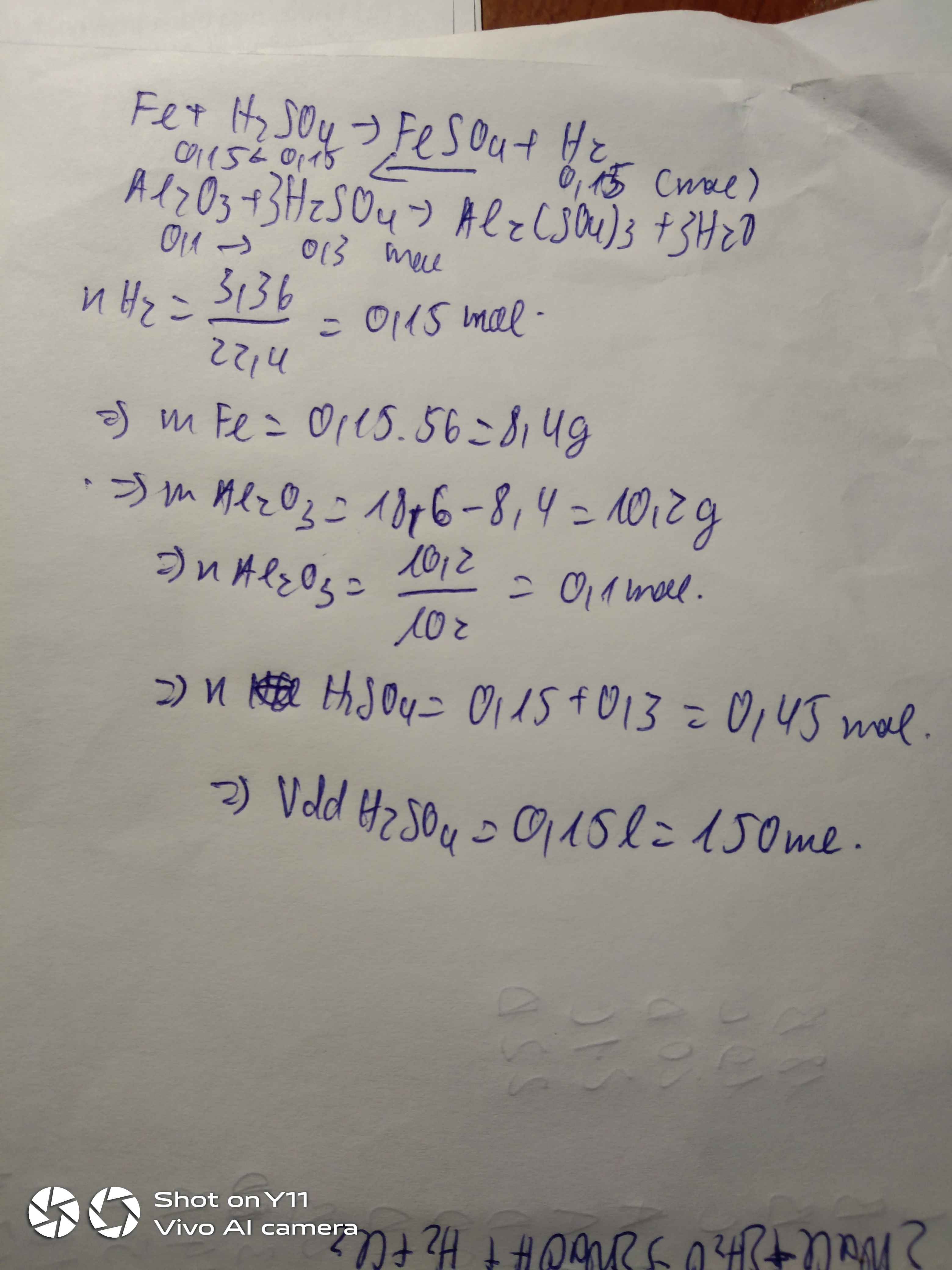Có một hh gồm Al2O3; Fe2O3 ; CaCO3 trong đó Al2O3 chiếm 10,2% ; Fe2O3 chiếm 9,8%.Đem nung hh ở nhiệt độ cao thu đc chất rẳn có khối lượng 67% khối lượng hh ban đầu. Tính khối lượng các chất trong chất rắn thu đc

Những câu hỏi liên quan
Hóa Học · Lớp 8Có một hh gồm CaCO3, MgCO3 và Al2O3 trong đó khối lượng Al2O3 nặng bằng 1/8 khối lượng muối cacbonat. Đem nung nóng hh đến khi hh bị phân hủy hoàn toàn ta thu được chất rắn có khối lượng bằng 6/10 khối lượng của hh ban đầu. a) Viết PTHH b) Tính thành phần % về khối lượng của MgCO3 trong hh ban đầu?mn nhanh một chút ,mik đang cần gấp
Đọc tiếp
Hóa Học · Lớp 8
Có một hh gồm CaCO3, MgCO3 và Al2O3 trong đó khối lượng Al2O3 nặng bằng 1/8 khối lượng muối cacbonat. Đem nung nóng hh đến khi hh bị phân hủy hoàn toàn ta thu được chất rắn có khối lượng bằng 6/10 khối lượng của hh ban đầu. a) Viết PTHH b) Tính thành phần % về khối lượng của MgCO3 trong hh ban đầu?
mn nhanh một chút ,mik đang cần gấp
Gọi KL của Al2O3 là x g thì KL muối Cacbonat là 8x g
=> KL hỗn hợp là 9x g
Do sau phân hủy thì khối lượng còn 6/10 ban đầu
=> KL CO2 bay đi là \(9x\left(1-\dfrac{6}{10}\right)=3,6x\)
Khi đó số mol muối cacbonat = số mol của CO2 = \(\dfrac{3,6x}{44}\)
Giờ ta giả sử cho dễ tính toán nha, để số tròn thì mình lấy x=11
Tổng khối lượng muối cacbonat là 88g => 100a + 84b = 88 (1)
Tổng số mol muối cacbonat là 0,9 mol => a + b = 0,9 (2)
Từ (1) và (2) ta có => a = 0,775 mol; b = 0,125 mol
=> %KL MgCO3 = \(\dfrac{\left(84x0,125\right)x100\%}{99}=10,6\%\)
Đúng 0
Bình luận (0)
a)
$CaCO_3 \xrightarrow{t^o} CaO + CO_2$
$MgCO_3 \xrightarrow{t^o} MgO + CO_2$
b)
Coi m hh = 102(gam)
Suy ra : m Al2O3 = 102/8 = 12,75(gam)
Gọi n CaCO3 = a(mol) ; n MgCO3 = b(mol)
=> 100a + 84b + 12,75 = 102(1)
m hh sau = 102.6/10 = 61,2(gam)
Bảo toàn khối lượng :
m CO2 = 102 -61,2 = 40,8(gam)
=> a + b = 40,8/44 = (2)
Từ (1)(2) suy ra a = 0,71 ; b = 153/704
Suy ra :
m MgCO3 = 153/704 .84 = 18,25(gam)
%m MgCO3 = 18,25/102 .100% = 17,9%
Đúng 2
Bình luận (1)
Cho 52,4g hhX gồm Na2CO3 Fe Al2O3 pư Hcl dư sau pư thu đc 7,437(l) hh khí Y dktc gồm H2;Co2 có dY/H2=8. Tính %m Al2O3 trog hhX?
\(n_{H_2}=a,n_{CO_2}=b\\ a+b=\dfrac{7,437}{24,79}=0,3mol\\ 2a+44b=0,3.8.2=4,8\\ a=0,2=n_{Fe}\\ b=0,1=n_{Na_2CO_3}\\ m_{Al_2O_3}=52,4-56.0,2-0,1.106=30,6g\\ \%m_{Al_2O_3}=\dfrac{30,6}{52,4}.100\%=58,40\%\)
Đúng 2
Bình luận (0)
Có một hh B gồm Al2O3 , MgCO3 , CaCO3 trong đó khối lượng Al2O3 bằng tổng khối lượng 2 muối cácbonat. Nung B đến khối lượng không đổi thì khối lượng chất rắn còn lại chỉ bằng khối lượng của B .Xác định % khối lượng mỗi chất trong B . ( 11,11%; 10,61% ;78,28% )
Đọc tiếp
Có một hh B gồm Al2O3 , MgCO3 , CaCO3 trong đó khối lượng Al2O3 bằng tổng khối lượng 2 muối cácbonat. Nung B đến khối lượng không đổi thì khối lượng chất rắn còn lại chỉ bằng
khối lượng của B .Xác định % khối lượng mỗi chất trong B . ( 11,11%; 10,61% ;78,28% )
Hòa tan 18,6g hh gồm Fe và Al2O3 bằng một lượng dd H2SO4 loãng 3M vừa đủ thu được 3,36 lít khí ở đktc với dd A
a, Tính 2 khối lượng mỗi chất có trong hh ban đầu
b, Tính Vdd H2SO4 đã dùng ( thể tích thay đổi không đáng kể ).
Giúp e với ạ mai em có bài kiểm tra T-T
Thổi từ hh khí X gồm CO và H2 đi qua ống đựng 16,8g hh Y gồm 3 oxit CuO, Fe3O4, Al2O3 nung nóng. Sau khi PƯ hoàn toàn thu được m g chất rắn Z và 1 hh khí T, hh khí T nặng hơn hh khí X là 0,32 g. Gía trị của m là ?
mO(mất đi) = 0,32 (g)
mZ = 16,8 - 0,32 = 16,48(g)
Đúng 3
Bình luận (0)
hoà tan 36,6 g hh gồm Al2o3 và Zno vừa đủ vào 400 g dd HCl 14,6%
a) xđ % Klg mỗi oxit trong hh bđ
b) xđ C% các chất trong ddx
Gọi số mol Al2O3 và ZnO có trong hỗn hợp lần lượt là x và y (x,y>0)
\(m_{hh}=m_{Al2O3}+m_{ZnO}=102x+81y=36,6\left(I\right)\)
\(m_{HCl}=14,6\%.400=58,4\left(g\right)\rightarrow n_{HCl}=\dfrac{58,4}{36,5}=1,6\left(mol\right)\)
\(Al2O3+6HCl\rightarrow2AlCl3+3H2O\left(1\right)\)
\(ZnO+2HCl\rightarrow ZnCl2+H2O\left(2\right)\)
\(\left(1\right),\left(2\right)\rightarrow n_{HCl}=n_{Al2O3}.6+n_{ZnO}.2=6x+2y=1,6\left(II\right)\)
Giải hệ (I) và (II) ta được : \(x=y=0,2\left(mol\right)\)
a) xđ % Klg mỗi oxit trong hh bđ
\(m_{Al2O3}=102.0,2=20,4\left(g\right)\rightarrow\%m_{Al2O3}=\dfrac{20,4}{36,6}.100\%=55,74\left(\%\right)\)
\(\%m_{ZnO}=100\%-55,74\%=44,26\%\)
b) xđ C% các chất trong ddx
Sau (1) và (2) ta thu được dung dịch gồm:\(\left\{{}\begin{matrix}AlCl3:0,4\left(mol\right)\\ZnCl2:0,2\left(mol\right)\end{matrix}\right.\rightarrow\left\{{}\begin{matrix}m_{AlCl3\left(dd\right)}=0,4.133,5=53,4\left(g\right)\\m_{ZnCl2}=0,2.136=27,2\left(g\right)\end{matrix}\right.\)
\(m_{dd}=36,6+400=436,6\left(g\right)\)
\(C\%_{AlCl3}=\dfrac{53,4}{436,6}.100\%=12,23\left(\%\right)\)
\(C\%_{ZnCl2}=\dfrac{27,2}{436,6}.100\%=6,115\left(\%\right)\)
Đúng 1
Bình luận (0)
Một hh A gồm Fe2O3 và Al2O3 có tỉ lệ mol tương ứng là 1:2. Tính thể tích khí H2 cần dùng( đktc) để khử hoàn toàn 18,2g hh A trên
Gọi nFe2O3=a(mol)⇒nAl2O3=2a(mol)
⇒mA=160a+102.2a=18,2(gam)⇒a=0,05
Trong hỗn hợp A, chỉ có Fe2O3 tác dụng với H2
Fe2O3+3H2to→2Fe+3H2O
⇒nH2=3nFe2O3=0,05.3=0,15(mol)
⇒VH2=0,15.22,4=3,36(lít)
Đúng 0
Bình luận (0)
Bài 3: Nung 2,22g hh X gồm Al2O3, MgO, Fe2O3 trong dòng khí CO dư đến pư hoàn toàn, thu được chất rắn Y có khối lượng 1,98 g. Để hòa hết lượng Y trên cần 100ml dd HCl 1M. Tính % khối lượng mỗi chất trong hh X.
Đặt \(\left\{{}\begin{matrix}n_{Al_2O_3}=a\left(mol\right)\\n_{MgO}=b\left(mol\right)\\n_{Fe_2O_3}=c\left(mol\right)\end{matrix}\right.\) \(\Rightarrow102a+40b+160c=2,22\)
\(Al_2O_3,MgO\) không bị khử bởi \(CO\)
\(PTHH:Fe_2O_3+3CO\underrightarrow{t^o}2Fe+3CO_2\)
\(\left(mol\right)\) \(c\) \(2c\)
\(\Rightarrow102a+40b+56.2c=1,98\)
\(PTHH:Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
\(\left(mol\right)\) \(a\) \(6a\)
\(PTHH:MgO+2HCl\rightarrow MgCl_2+H_2O\)
\(\left(mol\right)\) \(b\) \(2b\)
\(PTHH:Fe+2HCl\rightarrow FeCl_2+H_2\)
\(\left(mol\right)\) \(2c\) \(4c\)
\(\Rightarrow6a+2b+4c=0,1\)
Từ đó: \(\left\{{}\begin{matrix}a=0,01\left(mol\right)\\b=0,01\left(mol\right)\\c=0,005\left(mol\right)\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}\%m_{Al_2O_3}=45,95\left(\%\right)\\\%m_{MgO}=18,02\left(\%\right)\\\%m_{Fe_2O_3}=36,03\left(\%\right)\end{matrix}\right.\)
Đúng 1
Bình luận (0)
3. Đặt nAl2O3= x, nMgO=y, nFe2O3 = z
PTHH:
Fe2O3 + 3CO-----> 2Fe + 3CO2
Al2O3 + 6HCl ------> 2AlCl3 + 3H2O
MgO + 2HCl --------> MgCl2 + H2O
Fe + 2HCl -------> FeCl2 + H2
Ta có khối lượng của hỗn hợp X : \(102x+40y+160z=2,22\) (1)
Chất rắn Y gồm Fe, MgO và Al2O3
=> \(56.2z+102x+40y=1,98\) (2)
Theo PT ta có : \(n_{HCl}=6x+2y+2z.2=0.1.1\) (3)
Từ (1), (2), (3) => x=0,01 ; y=0,01, z= 0,005
=> \(\%m_{Al_2O_3}=\dfrac{0,01.102}{2,22}.100=45,95\%\)
\(\%m_{MgO}=\dfrac{0,01.102}{2,22}.100=18,01\%\)
=>\(\%m_{Fe_2O_3}=\dfrac{0,005.160}{2,22}.100=36,04\%\)
Đúng 0
Bình luận (0)
hh A gồm CuO,Fe2O3,Al2O3. Để khử hết 200 g hh A cần dùng hết V lít H2(đktc), sau khi các PƯ xảy ra hoàn toàn thu được chất rắn B có khối lượng là 156 g (Biết tỉ lệ số mol giữa CuO và Fe2O3 trong hh A là 1:1,5)a, tính V ở đktcb, tính % khối lượng mỗi chất trong hh Ac, Nếu 1/5 lượng khí H2 dùng ở trên PƯ với 36 g FeO thu được 29,6 g chất rắn. Tính hiệu suất PƯ
Đọc tiếp
hh A gồm CuO,Fe2O3,Al2O3. Để khử hết 200 g hh A cần dùng hết V lít H2(đktc), sau khi các PƯ xảy ra hoàn toàn thu được chất rắn B có khối lượng là 156 g (Biết tỉ lệ số mol giữa CuO và Fe2O3 trong hh A là 1:1,5)
a, tính V ở đktc
b, tính % khối lượng mỗi chất trong hh A
c, Nếu 1/5 lượng khí H2 dùng ở trên PƯ với 36 g FeO thu được 29,6 g chất rắn. Tính hiệu suất PƯ
a) Gọi số mol H2 là x
=> \(n_{H_2O}=x\left(mol\right)\)
Theo ĐLBTKL: \(m_A+m_{H_2}=m_B+m_{H_2O}\)
=> 200 + 2x = 156 + 18x
=> x = 2,75 (mol)
=> \(V_{H_2}=2,75.22,4=61,6\left(l\right)\)
b) Gọi \(\left\{{}\begin{matrix}n_{CuO}=a\left(mol\right)\\n_{Fe_2O_3}=1,5a\left(mol\right)\\n_{Al_2O_3}=b\left(mol\right)\end{matrix}\right.\)
=> 80a + 240a + 102b = 200
=> 320a + 102b = 200
PTHH: CuO + H2 --to--> Cu + H2O
a---------------->a
Fe2O3 + 3H2 --to--> 2Fe + 3H2O
1,5a------------------>3a
=> 64a + 168a + 102b = 156
=> 232a + 102b = 156
=> a = 0,5; b = \(\dfrac{20}{51}\)
=> \(\left\{{}\begin{matrix}\%m_{CuO}=\dfrac{0,5.80}{200}.100\%=20\%\\\%m_{Fe_2O_3}=\dfrac{0,75.160}{200}.100\%=60\%\\\%m_{Al_2O_3}=\dfrac{\dfrac{20}{51}.102}{200}.100\%=20\%\end{matrix}\right.\)
c) \(n_{H_2}=\dfrac{2,75}{5}=0,55\left(mol\right)\)
\(n_{FeO\left(tt\right)}=\dfrac{36}{72}=0,5\left(mol\right)\)
Gọi số mol FeO phản ứng là t (mol)
PTHH: FeO + H2 --to--> Fe + H2O
t--------------->t
=> 56t + (0,5-t).72 = 29,6
=> t = 0,4 (mol)
=> \(H\%=\dfrac{0,4}{0,5}.100\%=80\%\)
Đúng 4
Bình luận (0)