Hảy cho biết sốp, số e trong mỗi nguyên tử của các nguyên tố: Na, Mg, Fe, Cl.

Những câu hỏi liên quan
Nguyên tử của nguyên tố X có tổng số hạt electron trong các phân lớp p là 7. Số hạt mang điện của một nguyên tử Y nhiều hơn số hạt mang điện của một nguyên tử X là 8 hạt. Các nguyên tố X và Y lần lượt là (biết số hiệu nguyên tử của nguyên tố: Na 11; Al 13; P 15; Cl 17; Fe 26) A. Fe và Cl. B. Na và Cl. C. Al và Cl. D. Al và P.
Đọc tiếp
Nguyên tử của nguyên tố X có tổng số hạt electron trong các phân lớp p là 7. Số hạt mang điện của một nguyên tử Y nhiều hơn số hạt mang điện của một nguyên tử X là 8 hạt. Các nguyên tố X và Y lần lượt là (biết số hiệu nguyên tử của nguyên tố: Na = 11; Al = 13; P = 15; Cl = 17; Fe = 26)
A. Fe và Cl.
B. Na và Cl.
C. Al và Cl.
D. Al và P.
Đáp án C
Nguyên tử nguyên tố X có tổng số hạt electron trong các phân lớp p là 7 → Cấu hình electron của X: 1s22s22p63s23p1
Số electron của X = 13 → số hạt mang điện của X = 2 x 13 = 26.
Số hạt mang điện của Y = 26 + 8 = 34 → Y có số hiệu nguyên tử Z = 34 : 2 = 17
→ X, Y lần lượt là Al và Cl → Chọn C.
Đúng 0
Bình luận (1)
Biết số proton của các nguyên tố : C là 6, Na là 11. Cho biết số e trong nguyên tử, số lớp e và số e lớp ngoài cùng của mỗi nguyên tử?
Mik ko vẽ đc, bn có thể dựa vào:
vòng đầu tối đa 2 e
vòng 2 tối đa 8 e, cứ tiếp như vậy
Đúng 0
Bình luận (1)
\(Z=6\left(C\right)\)
-Số e:6 hạt
-Số lớp e:2
-Số e lớp ngoài cùng:4
\(Z=11\left(Na\right)\)
-Số e:11
-Số lớp e:3
-Số e lớp ngoài cùng:1
Đúng 2
Bình luận (0)
Dựa vào hóa trị của các nguyên tố trong bảng 6.1 và quy tắc hóa trị, hãy cho biết mỗi nguyên tử Mg có thể kết hợp được với bao nhiêu nguyên tử Cl.

Ta có:
- Hóa trị của Mg: II
- Hóa trị của Cl: I
Vì vậy hai nguyên tử Cl sẽ bằng 1 nguyên tử Mg ⇒ Mg có thể liên kết với 2 nguyên tử Cl ⇒ Công thức hóa học tổng quát: MgCl2.
Đúng 1
Bình luận (0)
Ở trạng thái cơ bản: - Phân lớp electron ngoài cùng của nguyên tử nguyên tố X là np2n+1. - Tổng số electron trên các phân lớp p của nguyên tử nguyên tố Y là 7. - Số hạt mang điện trong nguyên tử nguyên tố Z nhiều hơn số hạt mang điện trong nguyên tử nguyên tố X là 20 hạt. Nhận xét nào sau đây là sai? ( biết Z 7 là F; Z 17 là Cl; Z - 11 là Na; Z 12 là Mg; Z 13 là Al; Z 19 là K) A. Số oxi hóa cao nhất của X trong hợp chất là +7 B. Oxit và hiđroxit của Y có tính lưỡng tính C. Độ âm đi...
Đọc tiếp
Ở trạng thái cơ bản:
- Phân lớp electron ngoài cùng của nguyên tử nguyên tố X là np2n+1.
- Tổng số electron trên các phân lớp p của nguyên tử nguyên tố Y là 7.
- Số hạt mang điện trong nguyên tử nguyên tố Z nhiều hơn số hạt mang điện trong nguyên tử nguyên tố X là 20 hạt. Nhận xét nào sau đây là sai? ( biết Z = 7 là F; Z = 17 là Cl; Z - 11 là Na; Z = 12 là Mg; Z = 13 là Al; Z = 19 là K)
A. Số oxi hóa cao nhất của X trong hợp chất là +7
B. Oxit và hiđroxit của Y có tính lưỡng tính
C. Độ âm điện giảm dần theo thứ tự X, Y, Z
D. Nguyên tố X và Y thuộc 2 chu kì kế tiếp
Chọn A.
- Y có cấu hình e là : 1s22s22p63s23p1. Y là Al.
- Với X, do ep= 2n+1 ≤ 6 và 2≤ n (n=2 trở lên mới có phân lớp p)nên n=2
→ X có cấu hình e là : 1s22s22p5. X là F. Số oxi hóa cao nhất của F trong hợp chất là -1.
Đúng 0
Bình luận (0)
Cho độ âm điện của các nguyên tố: O (3,5), Na (0,9), Mg (1,2), Cl (3,0). Trong các phân tử sau, phân tử nào có độ phân cực lớn nhất ?
A. NaCl.
B. Cl2O.
C. MgO.
D. MgCl2.
Cho độ âm điện của các nguyên tố: O (3,44), Na (0,9), Mg (1,2), Cl (3,16). Trong các phân tử sau phân tử nào có độ phân cực lớn nhất ?
A. NaCl.
B. MgO.
C. MgCl2.
D. Cl2O
Đáp án A
Hiệu độ âm điện giữa hai nguyên tử tham gia liên kết trong các phân tử
- NaCl: hiệu độ âm điện của Cl và Na là 3,16 - 0,9 = 2,26.
- MgO: hiệu độ âm điện của O và Mg là 3,44 - 1,2 = 2,24.
- MgCl2: hiệu độ âm điện của Cl và Mg là 3,16 - 1,2 = 1,96.
- Cl2O: hiệu độ âm điện của O và Cl là 3,44 - 3,16 = 0,28.
Hiệu độ âm điện càng lớn thì phân tử có độ phân cực càng lớn.
Vậy phân tử có độ phân cực nhất là NaCl
Đúng 0
Bình luận (0)
Cho độ âm điện của các nguyên tố: O (3,44), Na (0,9), Mg (1,2), Cl (3,16). Trong các phân tử sau phân tử nào có độ phân cực lớn nhất
Đọc tiếp
Cho độ âm điện của các nguyên tố: O (3,44), Na (0,9), Mg (1,2), Cl (3,16). Trong các phân tử sau phân tử nào có độ phân cực lớn nhất
![]()
![]()
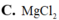
![]()
Cho độ âm điện của các nguyên tố: O (3,5), Na (0,9), Mg (1,2), Cl (3,0). Trong các phân tử sau, phân tử nào có độ phân cực lớn nhất A. NaCl B. Cl2O C. MgO D. MgCl2
Đọc tiếp
Cho độ âm điện của các nguyên tố: O (3,5), Na (0,9), Mg (1,2), Cl (3,0). Trong các phân tử sau, phân tử nào có độ phân cực lớn nhất
A. NaCl
B. Cl2O
C. MgO
D. MgCl2
Đáp án C
MgO
Sự phân cực của liên kết hóa học giữa hai nguyên tử tỉ lệ thuận với hiệu độ âm điện của chúng. Suy ra trong các phân tử NaCl, MgCl2, MgO, Cl2O thì liên kết trong phân tử MgO có sự phân cực mạnh nhất.
Đúng 0
Bình luận (0)
Viết cấu hình electron nguyên tử của các nguyên tố sau đây : Al, Mg, Na, Ne. Từ các cấu hình đó hãy cho biết các nguyên tử Al, Mg, Na, mỗi nguyên tử nhường mấy electron thì có cấu hình electron giống như của khí hiếm Ne.
Hãy cho biết tại sao các nguyên tử kim loại lại có khuynh hướng nhường electron để trở thành các ion dương ?
Cấu hình electron của Al, Mg, Na, Ne :
Al 1 s 2 2 s 2 2 p 6 3 s 2 3 p 1 |
Mg 1 s 2 2 s 2 2 p 6 3 s 2 |
Na 1 s 2 2 s 2 2 p 6 3 s 1 |
Ne 1 s 2 2 s 2 2 p 6 |
Từ các cấu hình trên ta dễ dàng thấy rằng nếu :
nguyên tử Na nhường le để trở thành ion Na + ;
nguyên tử Mg nhường 2e để trở thành ion Mg 2 + ;
nguyên tử Al nhường 3e để trở thành ion Al 3 + ,
thì các ion được hình thành có cấu hình electron giống cấu hình electron của khí hiếm Ne với 8 electron ở lớp ngoài cùng.
Ta đã biết cấu hình electron của các khí hiếm với 8 electron (đối với He là electron) ở lớp ngoài cùng là một cấu hình electron vững bền. Vì vậy, các nguyên tử kim loại có khuynh hướng dễ nhường electron để có cấu hình electron vững bền của khí hiếm đứng trước.
Đúng 0
Bình luận (0)











