Đốt nóng 12 tấn FeS2 với oxi. Sau khi p/ứ hoàn toàn thì thu đc bao nhiêu tấn Fe2O3

Những câu hỏi liên quan
Đốt cháy hoàn toàn m gam hỗn hợp X gồm FeO,
F
e
2
O
3
,
F
e
3
O
4
,
F
e
S
2
cần dùng 0,6 mol
O
2
, thu được 0,4 mol
F
e
2
O...
Đọc tiếp
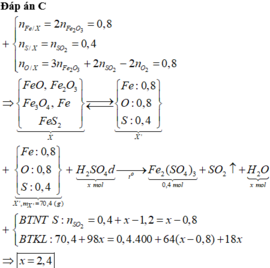
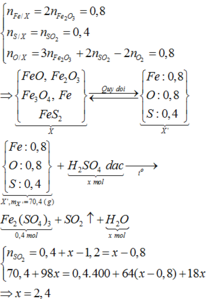
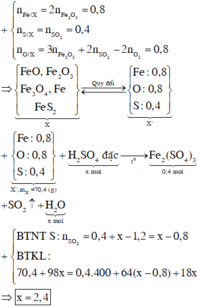
Đốt cháy hoàn toàn m gam hỗn hợp X gồm FeO, F e 2 O 3 , F e 3 O 4 , F e S 2 cần dùng 0,6 mol O 2 , thu được 0,4 mol F e 2 O 3 và 0,4 mol S O 2 . Cho m gam hỗn hợp X trên tác dụng với dung dịch H 2 S O 4 đặc nóng, dư đến khi các phản ứng xảy ra hoàn toàn, sản phẩm khử duy nhất là S O 2 thì số mol H 2 S O 4 tham gia phản ứng là bao nhiêu
A. 2,8 mol.
B. 2,0 mol.
C. 2,4 mol.
D. 1,6 mol.
Đốt cháy hoàn toàn m gam hỗn hợp X gồm FeO, Fe2O3, Fe3O4, FeS2 cần dùng 0,6 mol O2, thu được 0,4 mol Fe2O3 và 0,4 mol SO2. Cho m gam hỗn hợp X trên tác dụng với dung dịch H2SO4 đặc nóng, dư đến khi các phản ứng xảy ra hoàn toàn, sản phẩm khử duy nhất là SO2 thì số mol H2SO4 tham gia phản ứng là bao nhiêu? A. 2,8 mol B. 2,0 mol C. 2,4 mol D. 1,6 mol
Đọc tiếp
Đốt cháy hoàn toàn m gam hỗn hợp X gồm FeO, Fe2O3, Fe3O4, FeS2 cần dùng 0,6 mol O2, thu được 0,4 mol Fe2O3 và 0,4 mol SO2. Cho m gam hỗn hợp X trên tác dụng với dung dịch H2SO4 đặc nóng, dư đến khi các phản ứng xảy ra hoàn toàn, sản phẩm khử duy nhất là SO2 thì số mol H2SO4 tham gia phản ứng là bao nhiêu?
A. 2,8 mol
B. 2,0 mol
C. 2,4 mol
D. 1,6 mol
Đốt cháy hoàn toàn m gam hỗn hợp X gồm FeO, Fe2O3, Fe3O4, FeS2 cần dùng 0,6 mol O2, thu được 0,4 mol Fe2O3 và 0,4 mol SO2. Cho m gam hỗn hợp X trên tác dụng với dung dịch H2SO4 đặc nóng, dư đến khi các phản ứng xảy ra hoàn toàn, sản phẩm khử duy nhất là SO2 thì số mol H2SO4 tham gia phản ứng là bao nhiêu? A. 2,8 mol B. 2,0 mol C. 2,4 mol D. 1,6 mol
Đọc tiếp
Đốt cháy hoàn toàn m gam hỗn hợp X gồm FeO, Fe2O3, Fe3O4, FeS2 cần dùng 0,6 mol O2, thu được 0,4 mol Fe2O3 và 0,4 mol SO2. Cho m gam hỗn hợp X trên tác dụng với dung dịch H2SO4 đặc nóng, dư đến khi các phản ứng xảy ra hoàn toàn, sản phẩm khử duy nhất là SO2 thì số mol H2SO4 tham gia phản ứng là bao nhiêu?
A. 2,8 mol
B. 2,0 mol
C. 2,4 mol
D. 1,6 mol
a. Đun nóng hoàn toàn 18,96 gam KMnO4 thu đc bao nhiêu lít khí oxi ở đktc?
b. Đốt cháy 5,4g nhôm trong lượng khí oxi thu đc ở trên.
- Nhôm hay khí oxi, chất nào còn dư và dư bao nhiêu gam?
- Tính khối lượng nhôm oxit thu đc.
\(n_{KMnO_4}=\dfrac{18.96}{158}=0.12\left(mol\right)\)
\(2KMnO_4\underrightarrow{t^0}K_2MnO_4+MnO_2+O_2\)
\(0.12...........................................0.06\)
\(V_{O_2}=0.06\cdot22.4=1.344\left(l\right)\)
\(n_{Al}=\dfrac{5.4}{27}=0.2\left(mol\right)\)
\(4Al+3O_2\underrightarrow{t^0}2Al_2O_3\)
\(0.08.....0.06.......0.04\)
\(m_{Al\left(dư\right)}=\left(0.2-0.08\right)\cdot27=3.24\left(g\right)\)
\(m_{Al_2O_3}=0.04\cdot102=4.08\left(g\right)\)
Đúng 1
Bình luận (0)
FeS2 + O2 ---> Fe2O3 + SO2
nếu lấy 1 tấn quặng pirit sắt trên chứa 90 % FeSo2 thì sau phản ứng thu đc bao nhiêu kg khí SO2
2FeS2 + 11/2O2 ---> Fe2O3 +4SO2
m FeS2=1.90%=0,9(tấn)
Đổi: 0,9 tấn=900000000kg
n FeS2=900000000/120=7500000(mol)
Theo pthh
n SO2=2n FeS2=15000000(mol)
m SO2=15000000.64=960000000(g)=960000(kg)
Chúc bạn học tốt
Đốt cháy hoàn toàn m gam hỗn hợp X gồm FeS2 và một oxit sắt cần dùng 0,6 mol O2 thu được 0,4 mol Fe2O3 và 0,4 molSO2. Cho m gam hỗn hợp X trên tác dụng với dung dịch H2SO4 đặc nóng, dư đến khi các phản ứng xẩy ra hoàn toàn, sản phẩm khử duy nhất là SO2 thì số mol H2SO4 tham gia phản ứng là bao nhiêu?
đốt cháy hoàn toàn m gam fes2 và lấy toàn bộ sản phẩm khí thu đc cho hấp thụ hết bởi 5000 ml dd ca(oh)2 1M thu đc 12g kết tủa đun nóng dd thu đc sau phảm ứng thấy xuất hiện kết tủa nữa. tinh m
đốt cháy hoàn toàn m gam fes2 và lấy toàn bộ sản phẩm khí thu đc cho hấp thụ hết bởi 5000 ml dd ca(oh)2 1M thu đc 12g kết tủa đun nóng dd thu đc sau phảm ứng thấy xuất hiện kết tủa nữa. tinh m
Chất khí thoát ra là SO2
\(n_{Ca\left(OH\right)_2}=5\left(mol\right)\)
\(n_{CaSO_3}=0,1\left(mol\right)\)
Do sau khi đun nóng dung dịch thu được kết tủa nữa nên dung dịch là Ca(HSO3)2
Bảo toàn nguyên tố Ca => \(n_{Ca\left(HSO_3\right)_2}=5-0,1=4,9\left(mol\right)\)
Bảo toàn nguyên tố S: \(n_{FeS_2}.2=n_{CaSO_3}.1+n_{Ca\left(HSO_3\right)_2}.2=4,95\left(mol\right)\)
=> \(m_{FeS_2}=4,95.120=594\left(g\right)\)
Đúng 2
Bình luận (0)
Cho 10g hỗn hợp X gồm FeO, Fe2O3, S, FeS2, CuS (trong đó Oxi chiếm 16% về khối lượng) tác dụng vừa đủ với 0,335 mol H2SO4 đặc nóng sinh ra 0,2125 mol khí SO2 và dung dịch Y. Nhúng thanh Mg vào dung dịch Y, sau khi các phản ứng xảy ra hoàn toàn thì lấy thanh Mg ra thấy tăng 2,8g (giả sử 100% kim loại sinh ra bám vào thanh Mg). Đốt cháy hoàn toàn 10g X (sản phẩm gồm Fe2O3, CuO, SO2) bằng lượng vừa đủ V lit (dktc) hỗn hợp A gồm O2 và O3 tỉ lệ mol 1: 1. Giá trị của V là: A. 1,568 B. 1,5232 C. 1,...
Đọc tiếp
Cho 10g hỗn hợp X gồm FeO, Fe2O3, S, FeS2, CuS (trong đó Oxi chiếm 16% về khối lượng) tác dụng vừa đủ với 0,335 mol H2SO4 đặc nóng sinh ra 0,2125 mol khí SO2 và dung dịch Y. Nhúng thanh Mg vào dung dịch Y, sau khi các phản ứng xảy ra hoàn toàn thì lấy thanh Mg ra thấy tăng 2,8g (giả sử 100% kim loại sinh ra bám vào thanh Mg). Đốt cháy hoàn toàn 10g X (sản phẩm gồm Fe2O3, CuO, SO2) bằng lượng vừa đủ V lit (dktc) hỗn hợp A gồm O2 và O3 tỉ lệ mol 1: 1. Giá trị của V là:
A. 1,568
B. 1,5232
C. 1,4784
D. 1,4336
Đáp án C
Qui đổi hỗn hợp X thành: Fe(a mol) ; Cu(b mol) ; S(c mol) ; O (0,1 mol)
(Vì oxi chiếm 16% về khối lượng => mO = 10.16% = 1,6g => nO = 1,6: 16 = 0,1 mol)
mX = 56a + 64b + 32c + 0,1.16 = 10 (1)
Trong Y có Fe3+ (a mol) ; Cu2+ (b mol) ; SO42-.
Bảo toàn điện tích: 3nFe + 2nCu = 2nSO4 => nSO4 = ½ (3a + 2b)
Bảo toàn S: nS + nH2SO4 = nSO2 + nSO4 muối
=> 0,335 + c = ½ (3a + 2b) + 0,2125 (2)
Cho Mg dư vào Y: Bảo toàn e: nMg pứ. 2 = 3nFe3+ + 2nCu2+ => nMg pứ = ½ (3a + 2b)
mKL tăng = mFe + mCu - mMg pứ => 56a + 64b – 24. ½ (3a + 2b) = 2,8 (3)
Từ (1,2,3) => a = 0,1 ; b = 0,02 ; c = 0,0475 mol
- Oxi hóa X bằng O (Qui O2 và O3 về thành O). Bảo toàn electron:
2nO = 3nFe + 2nCu + 2nS – 2nO(X)
=> 2nO = 3a + 2b + 4c – 2.0,1 => nO = 0,165 mol
- Đặt nO2 = nO3 = u => nO = 2nO2 + 3nO3 = 5u = 0,165 mol => u = 0,033 mol
=> nA = 2u = 0,066 mol
=> V = 1,4784 lit
Đúng 0
Bình luận (0)
Mọi người giúp em câu này với ạ Đốt cháy hoàn toàn m gam FeS2 trong O2 thu được Fe2O3 và SO2. Hấp thụ hết SO2 vào dung dịch chứa -0,015 mol Ba(OH)2. Sau khi phản ứng xảy ra hoàn toàn thu được 2,17 gam kết tủa. Tính m. Cảm ơn mọi người đã trả lời ạ....