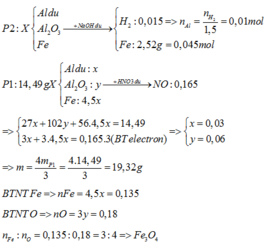để điều chế nhôm sunfua(Al2SO3)người ta đun nóng hỗn hợp gồm 27g Al và 60g S sau phản ứng thu được 75g sản phẩm . Điều này có đúng với định luật bảo toàn khối lượng không

Những câu hỏi liên quan
Tiến hành phản ứng nhiệt nhôm hỗn hợp A gồm Al và
Fe
x
O
y
(trong điều kiện không có không khí) được hỗn hợp B. Nghiền nhỏ, trộn đều hỗn hợp B rồi chia thành hai phần. - Phần 1 : có khối lượng 4,83 gam được hòa tan hết trong dung dịch
HNO
3
dư, đun nóng thu được dung dịch C và 1,232 lít NO (sản phẩm khử duy nhất). - Phần 2 : tác dụng với dung dịch NaOH dư đu...
Đọc tiếp
Tiến hành phản ứng nhiệt nhôm hỗn hợp A gồm Al và Fe x O y (trong điều kiện không có không khí) được hỗn hợp B. Nghiền nhỏ, trộn đều hỗn hợp B rồi chia thành hai phần.
- Phần 1 : có khối lượng 4,83 gam được hòa tan hết trong dung dịch HNO 3 dư, đun nóng thu được dung dịch C và 1,232 lít NO (sản phẩm khử duy nhất).
- Phần 2 : tác dụng với dung dịch NaOH dư đun nóng thu được 1,008 lít H 2 và còn lại 7,56 gam chất rắn.
Biết các phản ứng xảy ra hoàn toàn, thể tích các khí đo ở đktc. Công thức Fe x O y là
A. Fe 3 O 4
B. FeO
C. Fe 2 O 3
D. FeO hoặc Fe 3 O 4
Tiến hành phản ứng nhiệt nhôm hỗn hợp A gồm Al và
Fe
x
O
y
(trong điều kiện không có không khí) được hỗn hợp B. Nghiền nhỏ, trộn đều hỗn hợp B rồi chia thành hai phần. Phần 1 : có khối lượng 10,2 gam được hòa tan hết trong dung dịch
HNO
3
dư, đun nóng thu được dung dịch C và 2,912 lít NO (sản phẩm khử duy nhất). Phần 2 : tác dụng với dung dịch NaOH dư đun nóng thu được...
Đọc tiếp
Tiến hành phản ứng nhiệt nhôm hỗn hợp A gồm Al và Fe x O y (trong điều kiện không có không khí) được hỗn hợp B. Nghiền nhỏ, trộn đều hỗn hợp B rồi chia thành hai phần.
Phần 1 : có khối lượng 10,2 gam được hòa tan hết trong dung dịch HNO 3 dư, đun nóng thu được dung dịch C và 2,912 lít NO (sản phẩm khử duy nhất).
Phần 2 : tác dụng với dung dịch NaOH dư đun nóng thu được 0,672 lít H 2 đktc và còn lại 2,52 gam chất rắn.
Biết các phản ứng xảy ra hoàn toàn, thể tích các khí đo ở đktc. Công thức Fe x O y là
A. Fe 3 O 4
B. FeO
C. Fe 2 O 3
D. FeO hoặc F Fe 3 O 4
Nung Nóng Một Hỗn Hợp Gồm 8,1 G Bột Nhôm (al ) Và 9.6G Bột Lưu Huỳnh (S) Cho Phản Ứng Sảy Thu Dc Hoàn Toàn Là Nhôm Sunfua (Al2S3)..Tinh Khối Lượng Nhôm Sunfua Thu Đc???
PTHH: 2Al + 3S ===> Al2S3
=> nAl = 8,1 / 27 = 0,3 mol
=> nS = 9,6 / 32 = 0,3 mol
Lập tỉ lệ ===> Al dư, S hết
=> nAl(pứ) = 0,2 mol
=> mAl(pứ) = 0,2 x 27 = 5,4 gam
Áp dụng định luật bảo toàn khối lượng
=> mAl2S3 = 5,4 + 9,6 = 15 gam
Đúng 0
Bình luận (0)
mAl2S3=mAl+mS
mAl2S3=8,1+9,6=17,7
=>mAl2S3=17,7g
Đúng 0
Bình luận (3)
Theo địnhluật bảo toàn khối lượng ta có:
mAl + mS = mAl2S3
8,1 + 9,6 = mAl2S3
mAl2S3 = 17,7g
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Tiến hành phản ứng nhiệt nhôm hoàn toàn m gam hỗn hợp X gồm bột Al và FexOy trong điều kiện không có không khí thu được hỗn hợp Y. Nghiền nhỏ, trộng đều hỗn hợp Y rồi chia thành hai phần: - Phần 1: có khối lượng 14,49 gam được hòa tan hết trong dung dịch HNO3 loãng dư, đun nóng thu được dung dịch Z và 0,165 mol NO (sản phẩm khử duy nhất). - Phần 2: Đem tác dụng với dung dịch NaOH dư đun nóng thu được 0,015 mol khí H2 và còn lại 2,52 gam chất rắn. Công thức của oxit sắt và giá trị của m lần lượt...
Đọc tiếp
Tiến hành phản ứng nhiệt nhôm hoàn toàn m gam hỗn hợp X gồm bột Al và FexOy trong điều kiện không có không khí thu được hỗn hợp Y. Nghiền nhỏ, trộng đều hỗn hợp Y rồi chia thành hai phần:
- Phần 1: có khối lượng 14,49 gam được hòa tan hết trong dung dịch HNO3 loãng dư, đun nóng thu được dung dịch Z và 0,165 mol NO (sản phẩm khử duy nhất).
- Phần 2: Đem tác dụng với dung dịch NaOH dư đun nóng thu được 0,015 mol khí H2 và còn lại 2,52 gam chất rắn. Công thức của oxit sắt và giá trị của m lần lượt là:
A. Fe3O4 và 28,98.
B. Fe3O4 và 19,32.
C. FeO và 19,32.
D. Fe2O3 và 28,98.
Tiến hành phản ứng nhiệt nhôm hoàn toàn m gam hỗn hợp X gồm bột Al và FexOy trong điều kiện không có không khí thu được hỗn hợp Y. Nghiền nhỏ, trộn đều hỗn hợp Y rồi chia thành hai phần: – Phần 1 có khối lượng 14,49 gam được hòa tan hết trong dung dịch HNO3 loãng, dư, đun nóng thu được dung dịch Z và 0,165 mol NO ( sản phẩm khử duy nhất). – Phần 2 đem tác dụng với dung dịch NaOH dư đun nóng thu được 0,015 mol khí H2 và còn lại 2,52 gam chất rắn. Công thức của oxit sắt và g...
Đọc tiếp
Tiến hành phản ứng nhiệt nhôm hoàn toàn m gam hỗn hợp X gồm bột Al và FexOy trong điều kiện không có không khí thu được hỗn hợp Y. Nghiền nhỏ, trộn đều hỗn hợp Y rồi chia thành hai phần:
– Phần 1 có khối lượng 14,49 gam được hòa tan hết trong dung dịch HNO3 loãng, dư, đun nóng thu được dung dịch Z và 0,165 mol NO ( sản phẩm khử duy nhất).
– Phần 2 đem tác dụng với dung dịch NaOH dư đun nóng thu được 0,015 mol khí H2 và còn lại 2,52 gam chất rắn.
Công thức của oxit sắt và giá trị của m lần lượt là
A. Fe3O4 và 28,98.
B. Fe3O4 và 19,32.
C. FeO và 19,32.
D. Fe2O3 và 28,98.
Đáp án B
Nhiệt phân hoàn toàn X ⇒ Y gồm Fe, Al2O3 và Al dư.
Xét phần 2: nAl = nH2 ÷ 1,5 = 0,01 mol; nFe = 0,045 mol
⇒ ne cho TỐI ĐA = 0,01 × 3 + 0,045 × 3 = 0,165 mol.
⇒ phần 1 gấp 0,165 × 3 ÷ 0,165 = 3 lần phần 2.
Xét phần 1: chứa 0,03 mol Al; 0,135 mol Fe.
⇒ nAl2O3 = (14,49 – 0,03 × 27 – 0,135 × 56) ÷ 102 = 0,06 mol.
⇒ nO = 0,18 mol ⇒ x : y = 0,135 ÷ 0,18 = 3 : 4 ⇒ Fe3O4.
m = 4/3 × 14,49 = 19,32(g)
Đúng 0
Bình luận (0)
Tiến hành phản ứng nhiệt nhôm hoàn toàn m gam hỗn hợp X gồm bột Al và FexOy trong điều kiện không có không khí thu được hỗn hợp Y. Nghiền nhỏ, trộn đều hỗn hợp Y rồi chia thành hai phần: – Phần 1 có khối lượng 14,49 gam được hòa tan hết trong dung dịch HNO3 loãng, dư, đun nóng thu được dung dịch Z và 0,165 mol NO ( sản phẩm khử duy nhất). – Phần 2 đem tác dụng với dung dịch NaOH dư đun nóng thu được 0,015 mol khí H2 và còn lại 2,52 gam chất rắn. Công thức của oxit sắt và...
Đọc tiếp
Tiến hành phản ứng nhiệt nhôm hoàn toàn m gam hỗn hợp X gồm bột Al và FexOy trong điều kiện không có không khí thu được hỗn hợp Y. Nghiền nhỏ, trộn đều hỗn hợp Y rồi chia thành hai phần:
– Phần 1 có khối lượng 14,49 gam được hòa tan hết trong dung dịch HNO3 loãng, dư, đun nóng thu được dung dịch Z và 0,165 mol NO ( sản phẩm khử duy nhất).
– Phần 2 đem tác dụng với dung dịch NaOH dư đun nóng thu được 0,015 mol khí H2 và còn lại 2,52 gam chất rắn.
Công thức của oxit sắt và giá trị của m lần lượt là
A. Fe3O4 và 28,98.
B. Fe3O4 và 19,32.
C. FeO và 19,32.
D. Fe2O3 và 28,98.
Nhiệt phân hoàn toàn X
⇒ Y gồm Fe, Al2O3 và Al dư.
► Xét phần 2: nAl = nH2 ÷ 1,5 = 0,01 mol;
nFe = 0,045 mol
⇒ ne cho TỐI ĐA = 0,01 × 3 + 0,045 × 3 = 0,165 mol.
⇒ phần 1 gấp 0,165 × 3 ÷ 0,165 = 3 lần phần 2.
► Xét phần 1: chứa 0,03 mol Al; 0,135 mol Fe.
⇒ nAl2O3 = (14,49 – 0,03 × 27 – 0,135 × 56) ÷ 102 = 0,06 mol.
⇒ nO = 0,18 mol ⇒ x : y = 0,135 ÷ 0,18 = 3 : 4 ⇒ Fe3O4.
● m = × 14,49 = 19,32(g)
Đáp án B
Đúng 0
Bình luận (0)
Tiến hành phản ứng nhiệt nhôm hoàn toàn m gam hỗn hợp X gồm bột Al và FexOy trong điều kiện không có không khí thu được hỗn hợp Y. Nghiền nhỏ, trộn đều hỗn hợp Y rồi chia thành 2 phần: - Phần 1 có khối lượng 14,49 gam được hòa tan hết trong dung dịch HNO3 loãng, dư, đun nóng thu được dung dịch Z và 0,165 mol NO (sản phẩm khử duy nhất). - Phần 2 đem tác dụng với dung dịch NaOH dư đun nóng thu được 0,015 mol khí H2 và còn lại 2,52 gam chất rắn.Công thức của oxit sắt và giá trị của m lần lượt l...
Đọc tiếp
Tiến hành phản ứng nhiệt nhôm hoàn toàn m gam hỗn hợp X gồm bột Al và FexOy trong điều kiện không có không khí thu được hỗn hợp Y. Nghiền nhỏ, trộn đều hỗn hợp Y rồi chia thành 2 phần:
- Phần 1 có khối lượng 14,49 gam được hòa tan hết trong dung dịch HNO3 loãng, dư, đun nóng thu được dung dịch Z và 0,165 mol NO (sản phẩm khử duy nhất).
- Phần 2 đem tác dụng với dung dịch NaOH dư đun nóng thu được 0,015 mol khí H2 và còn lại 2,52 gam chất rắn.
Công thức của oxit sắt và giá trị của m lần lượt là
A. Fe3O4 và 28,98
B. Fe2O3 và 28,98
C. Fe3O4 và 19,32
D. FeO và 19,32
Đáp án C
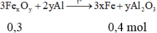
· Phần 2: + NaOH ® 0,015 mol H2
Þ Chứng tỏ phản ứng dư Al, oxit sắt phản ứng hết.
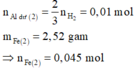
· Phần 1: 14,49 gam Y + HNO3 loãng, dư ® 0,165 mol NO.
Áp dụng bảo toàn electron có:

![]()
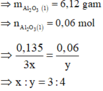
Þ Công thức oxit sắt là Fe3O4.
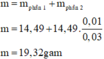
Đúng 0
Bình luận (0)
Tiến hành phản ứng nhiệt nhôm hoàn toàn m gam hỗn hợp X gồm bột Al và FexOy trong điều kiện không có không khí thu được hỗn hợp Y. Nghiền nhỏ, trộn đều hỗn hợp Y rồi chia thành 2 phần: - Phần 1 có khối lượng 14,49 gam được hòa tan hết trong dung dịch HNO3 loãng, dư, đun nóng thu được dung dịch Z và 0,165 mol NO (sản phẩm khử duy nhất). - Phần 2 đem tac dụng với dung dịch NaOH dư đun nóng thu được 0,015 mol khí H2 và còn lại 2,52 gam chất rắn. Công thức của oxit sắt và gia trị của m lần lượt là...
Đọc tiếp
Tiến hành phản ứng nhiệt nhôm hoàn toàn m gam hỗn hợp X gồm bột Al và FexOy trong điều kiện không có không khí thu được hỗn hợp Y. Nghiền nhỏ, trộn đều hỗn hợp Y rồi chia thành 2 phần:
- Phần 1 có khối lượng 14,49 gam được hòa tan hết trong dung dịch HNO3 loãng, dư, đun nóng thu được dung dịch Z và 0,165 mol NO (sản phẩm khử duy nhất).
- Phần 2 đem tac dụng với dung dịch NaOH dư đun nóng thu được 0,015 mol khí H2 và còn lại 2,52 gam chất rắn. Công thức của oxit sắt và gia trị của m lần lượt là
A. FeO và 19,32
B. Fe3O4 và 19,32
C. Fe3O4 và 28,98
D. Fe2O3 và 28,98
Phần 2 => mol Al = 0,01 ; mol Fe = 0,045 => ti lệ Al : Fe = 2/9
Đặt a, b, c là mol Al2O3 ; Al ; Fe
102a + 27b + 56c = 14,49
3b + 3c = 0,165*3
9b - 2c = 0
=> a = 0,06 ; b = 0,03 ; c = 0,135 => CT oxit sắt: Fe3O4
và phần 1 = 3*phần 2 => mol Al = 0,01 ; mol Fe = 0,045
=> ti lệ Al : Fe = 2/9 Đặt a, b, c là mol Al2O3 ; Al ; Fe
102a + 27b + 56c = 14,49 3b + 3c = 0,165*3
9b - 2c = 0
=> a = 0,06 ; b = 0,03 ; c = 0,135 => CT oxit sắt: Fe3O4
và phần 1 = 3*phần 2 => m = 19,32 2 => m = 19,32
=> Đap an B
Đúng 0
Bình luận (0)
Tiến hành phản ứng nhiệt nhôm hoàn toàn m gam hỗn hợp X gồm bột Al và FexOy trong điều kiện không có không khí thu được hỗn hợp Y. Nghiền nhỏ, trộn đều hỗn hợp Y rồi chia thành hai phần: – Phần 1 có khối lượng 14,49 gam được hòa tan hết trong dung dịch HNO3 loãng, dư, đun nóng thu được dung dịch Z và 0,165 mol NO ( sản phẩm khử duy nhất). – Phần 2 đem tác dụng với dung dịch NaOH dư đun nóng thu được 0,015 mol khí H2 và còn lại 2,52 gam chất rắn. Công thức của oxit sắt và giá trị của m lần lượ...
Đọc tiếp
Tiến hành phản ứng nhiệt nhôm hoàn toàn m gam hỗn hợp X gồm bột Al và FexOy trong điều kiện không có không khí thu được hỗn hợp Y. Nghiền nhỏ, trộn đều hỗn hợp Y rồi chia thành hai phần:
– Phần 1 có khối lượng 14,49 gam được hòa tan hết trong dung dịch HNO3 loãng, dư, đun nóng thu được dung dịch Z và 0,165 mol NO ( sản phẩm khử duy nhất).
– Phần 2 đem tác dụng với dung dịch NaOH dư đun nóng thu được 0,015 mol khí H2 và còn lại 2,52 gam chất rắn.
Công thức của oxit sắt và giá trị của m lần lượt là
A. Fe3O4 và 28,98.
B. Fe3O4 và 19,32.
C. FeO và 19,32
D. Fe2O3 và 28,98
Đáp án B
Nhiệt phân hoàn toàn X ⇒ Y gồm Fe, Al2O3 và Al dư.
► Xét phần 2: nAl = nH2 ÷ 1,5 = 0,01 mol; nFe = 0,045 mol
⇒ ne cho TỐI ĐA = 0,01 × 3 + 0,045 × 3 = 0,165 mol.
||⇒ phần 1 gấp 0,165 × 3 ÷ 0,165 = 3 lần phần 2.
► Xét phần 1: chứa 0,03 mol Al; 0,135 mol Fe.
||⇒ nAl2O3 = (14,49 – 0,03 × 27 – 0,135 × 56) ÷ 102 = 0,06 mol.
⇒ nO = 0,18 mol ⇒ x : y = 0,135 ÷ 0,18 = 3 : 4 ⇒ Fe3O4.
● m = 4 3 × 14,49 = 19,32(g)
Đúng 0
Bình luận (0)